Универсальность олеаноловая кислоты для использования в различных продуктах Ready To Ship Within 15 Days
Ищи олеаноловая кислоты. на Alibaba.com и просмотрите широкий выбор фантастических поставщиков. Экономьте деньги, запасаясь ингредиентом для использования в нескольких различных продуктах питания. Наиболее олеаноловая кислоты. выпускается в виде порошка, который хорошо растворяется и легко смешивается с другими ингредиентами. Используйте в качестве вкусного заменителя кофе без кофеина или для приготовления некоторых лекарственных трав. Производители продуктов питания и фармацевтические компании могут извлечь выгоду из использования этого полностью натурального ингредиента.Все олеаноловая кислоты. характеризуются очень высокой степенью чистоты, которая защищает конечный продукт от потенциальных загрязняющих веществ. Белые порошки сохраняют нейтральный вид при смешивании ингредиентов и не влияют на цвет.
Также доступны более темные экстракты, которые могут придать дополнительный оттенок конечному составу продукта. При проглатывании порошок инулина, содержащийся в продукте, может иметь пробиотические эффекты, которые со временем улучшают здоровье пищеварительной системы.
олеаноловая кислоты, продаваемый на Alibaba.com, соответствует стандартам пищевого и медицинского качества для обеспечения безопасности клиентов. Поставщики часто упаковывают продукты в вакуумные пакеты, чтобы сохранить свежесть и качество. Особенно большие партии обычно хранятся в бочках, которые легко транспортировать. Большинство экстрактов придают дополнительный сладкий вкус и придают рецепту более приятный вкус.
Просмотр олеаноловая кислоты. на Alibaba.com и наслаждайтесь низкой стоимостью важного ключевого ингредиента, используемого в различных фармацевтических препаратах и напитках для здоровья. Независимо от того, нужно ли потребителю улучшить здоровье пищеварительной системы или создать напитки с кофейным вкусом без кофеина, существует множество вариантов.
Присмотритесь к товарам и найдите лучших поставщиков, которые могут доставить в любом необходимом количестве.
|
Подорожник
В листьях растения содержится слизь (до 11%), гликозид аукубин, флавоноиды, горькие вещества. Содержатся также аскорбиновая кислота, витамин К, каротин. В семенах найдено до 44% слизи и жирное масло (16,7-22%), олеаноловая кислоты 1.
Свойства
Листья подорожника применяют в качестве отхаркивающего средства, противовоспалительного, кровоостанавливающего, ранозаживляющего, антимикробного.
Применение
Сок и настой листьев подорожника — прекрасное отхаркивающее средство, рекомендуется при острых и хронических болезнях органов дыхания. Сухие измельченные листья употребляют в форме настоя в качестве противовоспалительного и отхаркивающего средства при бронхитах, коклюше, астме и других заболеваниях органов дыхания.
Показания к применению подорожника
-
анацидный и гипоцидный гастриты,
-
язвенная болезнь желудка и двенадцатиперстной кишки с нулевой или пониженной секрецией соляной кислоты,
-
острые и хронические энтероколиты,
-
раны,
-
порезы,
-
ушибы,
-
хронические язвы,
-
фурункулы,
-
абсцессы,
-
воспалительные заболевания органов дыхания (бронхиты, пневмонии, тонзиллиты, коклюш, туберкулез).

Народная медицина считает подорожник противоопухолевым средством.
Препараты подорожника оказывают лечебное действие также при болезнях печени, почек, диабете, мужском и женском бесплодии, при хронических язвах, некоторых болезнях глаз, при кровотечениях — маточных, геморроидальных, желудочных и легочных.
Настой корней подорожника принимают как болеутоляющее средство — при укусах ядовитых насекомых и змей.
Хорошим средством при хронических поносах считается порошок из семян подорожника.
Листья подорожника в народной медицине широко используются как наружное средство при ранах, ссадинах, фурункулах и язвах. Прикладывают целые или смятые листья к участкам тела, поверх листьев делают теплый компресс.
Народная медицина рекомендует подорожник как при повышенной, так и при пониженной кислотности желудочного сока.
Места произрастания
Родина подорожника — Европа. Первыми переселенцами семена подорожника были завезены в Америку. Североамериканские индейцы это растение «следом белого человека». Подорожник широко распространен по всей террритории России, за исключением северных и северо-восточных территорий, пустынь. Растет на пустырях, сорных местах, вблизи жилья, вплоть до дорог и тропинок, на огородах, на лугах, по берегам рек и озер.
1 Мазнев Н.И. Энциклопедия лекарственных растений. 3-е изд., испр. и доп. — М.: Мартин, 2004. — с. 354.
Олеаноловая кислота, олеановая кислота, поставщик порошка олеаноловой кислоты, экстракт Ligustrum Lucidum, олеановая кислота, экстракт оливковых листьев
Олеаноловая кислота (олеановая кислота) ПодробнееНазвание продукта: олеановая кислота, олеаноловая кислота Источник трав: Canarium album (Lour. Используемая часть: лист: корневой клубень Внешний вид: белый игольчатый порошок Технические характеристики: 98% Метод испытания: ВЭЖХ. CAS-номер: 508-02-1 Молекулярная формула& Молекулярный вес: C30h58O3; 456,71 Олеаноловая кислота Структурная формула: |
Точка плавления& Растворимость: т.пл. 308 ~ 310 ° С. Нерастворим в воде. Растворим в метаноле, этаноле, эфире, ацетоне и хлороформе.
Фармакология: противовоспалительное, противораковое, сердечное мочегонное действие и гепатиника. Функционирует как гипогликемическое средство для лечения глюреза.
Что такое олеаноловая кислота?
Олеаноловая кислота, также называемая олеановой кислотой, представляет собой пентациклическое тритерпеноидное соединение, широко распространенное во всем царстве растений. Это нетоксичный, гепатопротекторный тритерпеноид, содержащийся в Phytolacca Americana, который обладает противоопухолевыми и противовирусными свойствами. Олеаноловая кислота эффективна для защиты от химического повреждения печени. Олеановая кислота относительно нетоксична и используется в косметике и товарах для здоровья. Было обнаружено, что олеаноловая кислота проявляет слабую активность против ВИЧ и слабую против HCV. Олеаноловая кислота и ее производные обладают несколькими многообещающими фармакологическими действиями, такими как гепатопротекторные, противовоспалительные, антиоксидантные или противоопухолевые свойства.
Олеаноловая кислота эффективна для защиты от химического повреждения печени. Олеановая кислота относительно нетоксична и используется в косметике и товарах для здоровья. Было обнаружено, что олеаноловая кислота проявляет слабую активность против ВИЧ и слабую против HCV. Олеаноловая кислота и ее производные обладают несколькими многообещающими фармакологическими действиями, такими как гепатопротекторные, противовоспалительные, антиоксидантные или противоопухолевые свойства.
Функции и преимущества олеаноловой кислоты
1. Натуральная олеаноловая кислота обладает гепатопротекторным, противогепатитным действием.
2. Олеаноловая кислота обладает противоопухолевым действием.
3. Порошок олеаноловой кислоты обладает функцией антиоксиданта.
4. Олеановая кислота обладает антимикробным, противовоспалительным и противовирусным действием.
5. Порошок олеановой кислоты обладает гиполипидемическим, антиатеросклерозным действием, снижает эффект глюкозы в крови.
6. Олеановая кислота может подавлять вирус СПИДа.
Олеановая кислота может подавлять вирус СПИДа.
7. Натуральная олеаноловая кислота обладает антидиабетическим, противоязвенным действием.
8. Олеаноловая кислота успокаивает и стабилизирует.
9. Олеаноловая кислота может усиливать иммунную функцию.
Применение олеаноловой кислоты
1. Порошок олеаноловой кислоты можно использовать в фармацевтической сфере в качестве сырья.
2. Натуральная олеаноловая кислота может использоваться как функциональная пища и пищевая добавка.
3. Олеановую кислоту можно использовать в косметической сфере в качестве сырья.
4. Порошок олеановой кислоты можно использовать в фармацевтической сфере.
Пакет& Место хранения
1. 1-5 кг с двойным пластиковым контейнером внутри / алюминиевой фольгой снаружи. 10 кг с двойным пластиковым контейнером внутри / картонной коробкой снаружи. 25 кг с двойным пластиковым контейнером внутри / фибровым барабаном снаружи или по вашему выбору.
2. Хранится в крутой& сухая, хорошо закрытая емкость, беречь от влаги и сильного света / тепла.
3. Срок годности: два года при хорошем хранении.
Транспорт& Оплата
1. Небольшая посылка отправлена EMS, UPS, FedEx, DHL и т. Д.
2. Все грузы, отправленные по воздуху или по морю, доступны.
3. Возможна оплата через Western Union, T / T, Paypal и т. Д.
Наши преимущества
1. Экстракционная мануфактура с фабрикой занимает площадь 35000 квадратных метров.
2. Удовлетворяйте ваши особые требования к спецификации продукта и требованиям к капсулам, мягким гелям, таблеткам и порошковым смесям.
3. Сертификаты: ISO9001, Kosher, Halal, ISO9001, HACCP, QS, NOP и китайская здоровая пища GMP и т. Д.
4. Наша цель: предоставить вам продукцию высочайшего качества, отличный сервис и быструю доставку с более чем 15-летним опытом работы’ опыт производства и исследований в области высококачественных натуральных ингредиентов.
5. Богатый опыт экспортного бизнеса; продукты и услуги были широко приняты клиентами из США, Европы, Австралии и т. д.
д.
Наши выставки
Ежегодно наша команда посещает множество отраслевых выставок по всему миру, таких как CPHI в Шанхае, Китае и Испании, Vitafood в Швейцарии, Engredea / NPEW в США и т. Д.
Новый взгляд на патогенез и лечение андрогенетической алопеции
Евгений КАРАСЕВ, к. м. н., врач-трихолог, Москва
Татьяна ВИННИК, PhD, врач-дерматовенеролог, трихолог, Астана
Андрогенетическая алопеция (АГА) – сложное мультифакториальное состояние, основным проявлением которого являются истончение и поредение волос в лобно-теменной зоне скальпа как у мужчин, так и у женщин.
АГА развивается с годами и является отражением сегментарного или органоспецифичного преждевременного старения. Рассматривается как неизбежное следствие, так как генетически обусловлена и проявляется у любого человека, как правило, после 30 лет.
«Виновным» геном в данном случае считается ген андрогенного рецептора (AR), который находится на хромосоме X. «Сидит» он латентно, никак себя не проявляя до поры до времени. У каждого индивидуума эта пора своя. Однако, если взглянуть в целом на мужскую половину человечества, в зависимости от активности этого гена их можно разделить на две довольно большие группы: мужчины с высокой активностью АГА-гена и мужчины с невысокой активностью того же гена. У представителей первой группы первые признаки облысения регистрируются в 18–20 лет, когда на лбу появляются ползущие на темя «андрогенетические заливы», формирующие примерно к 30–35 годам отчетливо проглядывающую букву «М». У представителей второй группы происходит то же самое (только с меньшей скоростью!), начинает формироваться примерно в 45 лет. Но финал у всех более или менее одинаковый – лобно-теменное облысение, если не принимать специальных лечебно-профилактических мер. Эволюция клинической картины развивается по сценарию, предложенному в 70-х годах прошлого века Норвудом–Гамильтоном.
«Сидит» он латентно, никак себя не проявляя до поры до времени. У каждого индивидуума эта пора своя. Однако, если взглянуть в целом на мужскую половину человечества, в зависимости от активности этого гена их можно разделить на две довольно большие группы: мужчины с высокой активностью АГА-гена и мужчины с невысокой активностью того же гена. У представителей первой группы первые признаки облысения регистрируются в 18–20 лет, когда на лбу появляются ползущие на темя «андрогенетические заливы», формирующие примерно к 30–35 годам отчетливо проглядывающую букву «М». У представителей второй группы происходит то же самое (только с меньшей скоростью!), начинает формироваться примерно в 45 лет. Но финал у всех более или менее одинаковый – лобно-теменное облысение, если не принимать специальных лечебно-профилактических мер. Эволюция клинической картины развивается по сценарию, предложенному в 70-х годах прошлого века Норвудом–Гамильтоном.
Итак, при АГА у мужчин никогда не редуцируются только волосы, образующие узкую кайму на висках и затылке.
Что же касается женской половины человечества, то она в зависимости от активности данного гена распадается на три довольно большие группы: лица с высокой активностью АГА-гена, со средней и с невысокой активностью того же гена. У представительниц первой группы первые признаки облысения регистрируются в 18–20 лет, когда в лобно-теменной зоне начинается постадийный процесс, описанный в 1977 году Людвигом (рис. 2).
У представительниц второй группы то же самое, только с меньшей скоростью, начинает формироваться в 35–40, а у третьей – при наступлении менопаузы, то есть в 50–55 лет.
В редких случаях чрезвычайно тяжелая АГА или ее раннее начало может быть симптомом сложного генетического заболевания, например трихоринофалангеального синдрома, прогерии, синдрома Ларона, миотонической дистрофии Куршмана – Штейнерта – Баттена и пр.
ПРИЧИНЫ РАЗВИТИЯ АГА
В основе развития АГА – генетически обусловленные особенности метаболизма андрогенов в волосяном фолликуле.
Наиболее значимым фактором у мужчин является повышенная активность фермента 5α-редуктазы II типа, которая в генетически предрасположенных волосяных фолликулах метаболизируют тестикулярный тестостерон в дигидротестостерон (ДГТ).
Помимо аналогичных с мужскими локальных метаморфоз андрогенов у женщин в патогенезе АГА, как правило, также большую роль играет снижение активности ароматазы, которая преобразует
циркулирующий в крови тестостерон яичников в 17 бета-эстрадиол.
Увеличение локальной концентрации ДГТ приводит к прогрессирующему сокращению анагена за счет более длительной фазы телогена (рис. 3) и сопровождается прогрессирующей миниатюризацией волосяных фолликулов. Последняя осуществляется за счет относительно резких сокращений количества клеток дермального сосочка и дермальной оболочки.
В дополнение к андрогензависимым изменениям в патогенезе АГА доказано вовлечение фолликулярного микровоспаления с формированием фиброза, спровоцированного присутствующей бактериальной флорой, токсинами и окислительным стрессом.
МЕТОДЫ ЛЕЧЕНИЯ
Лечение АГА прежде всего нацелено на увеличение волосяного покрова кожи головы и предотвращение истончения и поредения волос в будущем. На ранних стадиях оно эффективнее, поскольку изменения волосяных фолликулов не носят необратимого характера.
На ранних стадиях оно эффективнее, поскольку изменения волосяных фолликулов не носят необратимого характера.
Существуют как терапевтические, так и хирургические методы восстановления роста волос при АГА: прием модификаторов биологических реакций, гормональных и негормональных антиандрогенов, блокаторов 5α-редуктазы и трансплантация волос.
Так, примером патогенетических средств лечения АГА являются препараты растительного происхождения, получаемые из листьев оливкового дерева, вытяжки из корня лопуха, крапивы двудомной, у женщин – некоторые оральные контрацептивы и спиронолактон.
Радикальным методом восстановления волос при АГА является трансплантация собственных волосяных фолликулов. Принцип хирургического лечения заключается в перемещении андрогеннезависимых терминальных волосяных фолликулов из не подверженной облысению затылочной зоны в участки андрогензависимого поредения. Пересадка волос – это успешный метод лечения АГА с долговременным эффектом. Тем не менее естественное прогрессирование облысения будет продолжаться, и могут потребоваться последующие пересадки, чтобы трансплантированный участок не оказался окруженным кожей, лишенной волос.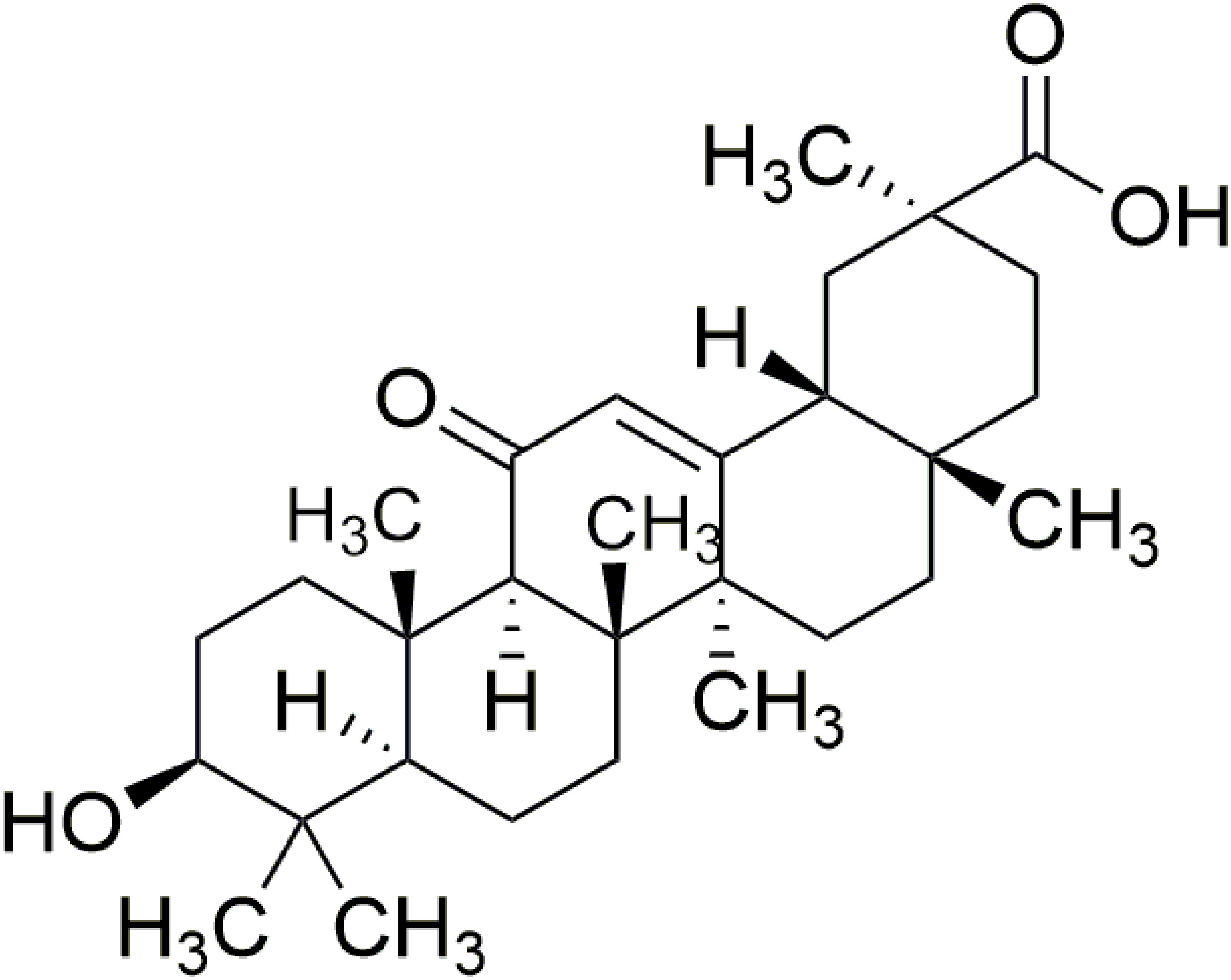
Среди наружных методов коррекции АГА упомянем классический миноксидил и ставшие популярными в последнее десятилетие трехфазные комплексы, содержащие «золотую троицу»: вазодилататор эпигенин, трипептидный фактор роста волос и олеаноловую кислоту. Последняя особенно важна при АГА, так как ингибирует 5α-редуктазу. Применяются эти средства по разным схемам в зависимости от стадии процесса. Одним из наиболее терапевтически успешных представителей этого класса препаратов является ДЕКОПИЛЛ™/DEKOPILL™ от медицинской компании Charismo (Даллас, США).
ЭФФЕКТИВНОЕ СРЕДСТВО КОРРЕКЦИИ АЛОПЕЦИЙ
ДЕКОПИЛЛ™ – это новейший запатентованный натуральный биоактивный пептидный комплекс с витаминами, аминокислотами и озонидами, предназначенный для замедления процесса патологического выпадения волос, прошедший испытания и показавший клинически значимые результаты защиты и восстановления фолликулов, а также улучшения структуры и здоровья волоса.
ДЕКОПИЛЛ™ предназначен для устранения основных симптомов патологической утраты волос большинства известных алопеций. Основной результат его действия заключается в продлении фазы роста волоса и улучшении устойчивости к вредному воздействию ДГТ, а также в увеличении кровообращения, усилении витаминизированного питания корней волос и поверхности кожи головы, вследствие чего замедляется процесс старения фолликулов.
Основной результат его действия заключается в продлении фазы роста волоса и улучшении устойчивости к вредному воздействию ДГТ, а также в увеличении кровообращения, усилении витаминизированного питания корней волос и поверхности кожи головы, вследствие чего замедляется процесс старения фолликулов.
Создатели препарата потратили 10 лет на разработку и клинические испытания, которые показали, что эффекты коррекции алопеций достоверно регистрируются через 30–90 дней от момента начала комплексного лечения.
Быстрое уменьшение количества выпадающих волос (после 30-дневного курса).
Активизация латентно существующих волос (от 0 до 3 мм после 90-дневного курса).
АКТИВНЫЕ КОМПОНЕНТЫ ПРЕПАРАТА:
- Вазодилататор эпигенин (вытяжка из цитрусовых) расширяет сосуды, стимулирует микроциркуляцию волосяных сосочков.
Доказано, что для эффективного лечебного воздействия при алопециях необходимо стимулировать кровообращение кожи головы не менее 8 часов в сутки.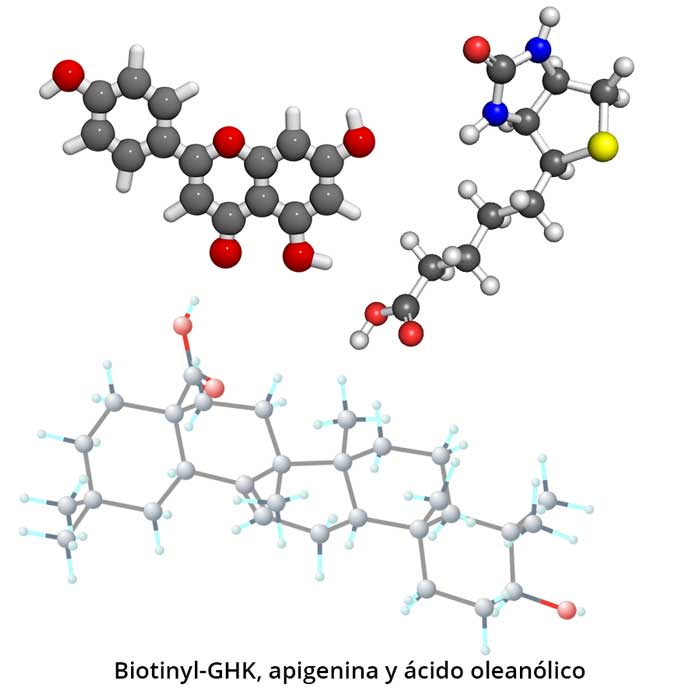 (Для сравнения: перец, горчица, имбирь стимулируют кровообращение не более 1 часа!) Именно этот эффект в препарате достигается с помощью эпигенина неэфиромасличного генеза, что предотвращает любые аллергические реакции.
(Для сравнения: перец, горчица, имбирь стимулируют кровообращение не более 1 часа!) Именно этот эффект в препарате достигается с помощью эпигенина неэфиромасличного генеза, что предотвращает любые аллергические реакции.
Возможны покраснения (так как происходит поверхностное расширение сосудов) при протекании на кожу лица или утром при споласкивании волос, которые исчезают через 5–10 минут.
- Биотинил-трипептид – рекомбинантный пептид, который является фактором роста. Ускоряет рост волос в длину до 40% (при применении 3-месячного курса) и в ширину, увеличивая прикорневойобъем.
- Олеаноловая кислота (вытяжка из листьев оливы). Нормализует обмен тестостерона в коже и увеличивает толщину волоса.
- Озониды – оливковое масло, насыщенное озоном.
Противопоказания: беременность, онкология в активной форме, частые эпилептические припадки.
ОСНОВНЫЕ ТЕРАПЕВТИЧЕСКИЕ ЭФФЕКТЫ ПРЕПАРАТА:
- Быстрое уменьшение количества выпадающих волос (после 30-дневного курса).

- Трихонеогенез – активизация роста латентно существующих волос (после 90-дневного курса).
СПОСОБ ПРИМЕНЕНИЯ ПРЕПАРАТА
Каждый вечер наносите от 5 до 9 полных пипеток лосьона на сухую поверхность кожи головы, мягко промассируйте голову и затем вымойте руки. Оставьте нанесенный лосьон как минимум на 8 часов. На следующее утро допустимо мытье или ополаскивание головы водой.
Минимальный курс применения – 30 дней, наиболее часто рекомендуемый курс применения – 90 дней.
1 упаковка рассчитана на 30-дневный курс – 120 мл (4 флакона х 30 мл).
Для наиболее быстрого и стойкого лечебного эффекта возможно применение лосьона ДЕКОПИЛЛ™ с другими терапевтическими методами:
- низкоинтенсивная лазерная терапия – от 1 до 3 раз в неделю;
- мезотерапия – 1 раз в 7–10 дней.
ЭПИЛОГ
В заключение хотелось бы сделать особый акцент на двух аспектах.
Во-первых, применение всех вышеперечисленных методов лечения не меняет генетическую программу волосяных фолликулов, поэтому терапевтические успехи данных мероприятий носят временный характер и их следует регулярно повторять в течение всей жизни пациента. Также необходимо исключать внутренние факторы (например, железодефицитную анемию, эндокринные заболевания и пр.), совместно с АГА ухудшающие состояние волос и приводящие к их хроническому диффузному поредению.
Также необходимо исключать внутренние факторы (например, железодефицитную анемию, эндокринные заболевания и пр.), совместно с АГА ухудшающие состояние волос и приводящие к их хроническому диффузному поредению.
Во-вторых, для скептиков отметим, что инновационный ДЕКОПИЛЛ прошел строгий дерматологический контроль в клиниках Европы и США, показав при этом свою эффективность и безопасность в результате клинических тестов, которые объективно выявили:
- активацию роста волос на 121%,
- значительную задержку старения волоса на 46%,
- улучшение энкоринга (фиксации в коже) волосяного стержня на 73%.
Уропрофит инструкция по применению: показания, противопоказания, побочное действие – описание Uroprofit Капсулы (53155)
БАД к пище. Действие обусловлено свойствами компонентов, входящих в его состав.
Экстракт ягод клюквы (Vaccinium oxycoccus). Основным действующим компонентом клюквы являются проантоцианидины, которые препятствуют прикреплению патогенных бактерий к стенкам мочевого пузыря и уретры, чем предотвращают размножение бактерий в мочевыводящих путях.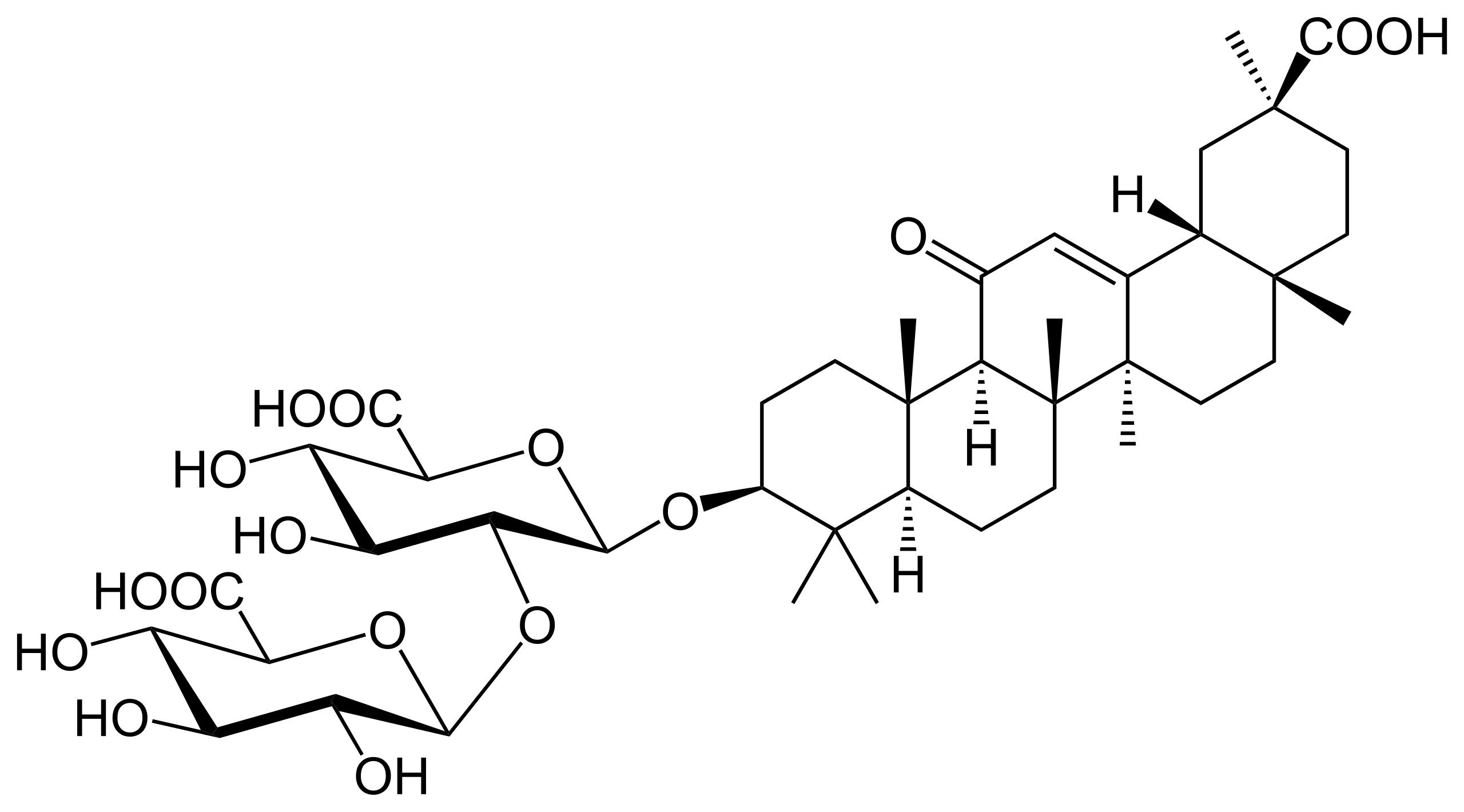 При приеме препаратов клюквы внутрь проантоцианидины в высоких концентрациях накапливаются в моче. Плоды клюквы содержат органические кислоты (лимонная, бензойная, яблочная, хинная и др.), аскорбиновую кислоту, витамины группы В, флавоновые кислоты, дубильные вещества, тритерпеноиды (урсоловая и олеаноловая кислоты), лейкоантоцианы, филлохинон (витамин К), гликозиды, микроэлементы (железо, марганец, медь, калий, кальций, фосфаты).
При приеме препаратов клюквы внутрь проантоцианидины в высоких концентрациях накапливаются в моче. Плоды клюквы содержат органические кислоты (лимонная, бензойная, яблочная, хинная и др.), аскорбиновую кислоту, витамины группы В, флавоновые кислоты, дубильные вещества, тритерпеноиды (урсоловая и олеаноловая кислоты), лейкоантоцианы, филлохинон (витамин К), гликозиды, микроэлементы (железо, марганец, медь, калий, кальций, фосфаты).
Обладает противовоспалительным, мочегонным, противомикробным и общеукрепляющим действием. Противомикробные свойства обусловлены наличием бензойной и хлорогеновой кислот, а противовоспалительное действие – наличием урсоловой кислоты. Усиливает действие уросептических препаратов из группы антибиотиков и сульфаниламидов.
Экстракт листьев толокнянки (Arctostaphylos uva-ursi). Основными действующими веществами толокнянки являются фенольные гликозиды, флавоноиды и дубильные вещества. Обладает противомикробным действием благодаря наличию в экстракте арбутина и метиларбутина, которые расщепляются в организме до гидрохинона, с выраженным антибактериальным действием, вследствие чего мочевыводящие пути очищаются от бактериальной флоры. Обладает противовоспалительным действием, т.к. содержит дубильные вещества. Флавоноиды, содержащиеся в толокнянке, повышают диурез с одновременным выведением из организма ионов натрия и хлора. Толокнянка тормозит реабсорбцию мочевой кислоты в почечных канальцах и увеличивает ее растворимость, снижая образование камней в мочевыводящих путях. Усиливает эффекты уросептических и противовоспалительных препаратов
Обладает противовоспалительным действием, т.к. содержит дубильные вещества. Флавоноиды, содержащиеся в толокнянке, повышают диурез с одновременным выведением из организма ионов натрия и хлора. Толокнянка тормозит реабсорбцию мочевой кислоты в почечных канальцах и увеличивает ее растворимость, снижая образование камней в мочевыводящих путях. Усиливает эффекты уросептических и противовоспалительных препаратов
Экстракт хвоща полевого (Equisetum arvense). Хвощ полевой содержит флавоноиды, органические кислоты, магний, кальций, хром, железо, калий, большое количество солей кремниевой кислоты. Способствует защите эпителия при воспалении, что обеспечивается удалением токсинов из мочевыводящих путей. Обладает мягким спазмолитическим эффектом. Флавоноиды хвоща обладают антисептическим действием.
Витамин С (аскорбиновая кислота). Повышает устойчивость организма к инфекциям. Снижает выраженность воспалительных реакций.
Иван-чай с кусочками карамелизированной моркови и чабрецом «Федотыч»
Полное описание
Состав: Иван-чай (кипрей узколистный) ферментированный, морковный чай, чабрец.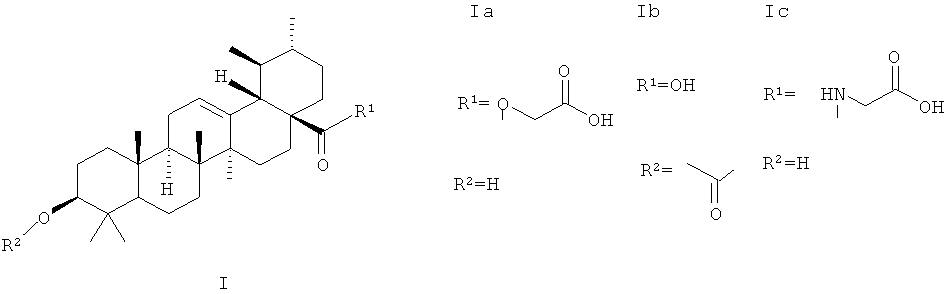
Масса нетто: 50 грамм.
Чай «Федотыч» с чабрецом — превосходный витаминный и энергетический напиток, обладающий мягким слегка сладковатым вкусом и приятным, легким пряным ароматом, красивого янтарного цвета.
Чай «Федотыч» с чабрецом соединяет все полезные свойства двух чаев (иван-чая и морковного чая) и чабреца (богородской травы). Иван чай содержит большое количество витамина С, важнейшие микроэлементы — железо, медь, никель, кальций, натрий, марганец. Морковный чай обогащает напиток витамином А и катехинами, веществами которые нейтрализуют свободные радикалы, улучшают обмен веществ и нормализуют вес. Чабрец содержит эфирное масло, основными компонентами которого являются тимол и карвакрол, а так же присутствуют урсоловая и олеаноловая кислоты. Урсоловая кислота обладает противовоспалительными и антимикробными свойствами, а олеаноловая кислота оказывает противораковое воздействие.
Чай «Федотыч» с чабрецом
— Укрепляет иммунитет.
— Отличное средство для профилактики и лечения заболеваний простаты.
— Обладает жаропонижающими свойствами.
— Повышенное содержание витамина С помогает скорейшему выздоровлению при простуде и гриппе.
— Ощелачивает кровь, способствует восстановлению сил при истощении.
— Уменьшает интоксикацию при любых болезненных состояниях в том числе онкологических.
— Обладает противовоспалительными свойствами, обволакивающим действием.
— Защищает сердце и сосуды.
— Улучшает процессы кроветворения.
— Мощный антиоксидант.
— Не содержит кофеин и щавелевую кислоту.
— Нормализует артериальное давление.
— Улучшает обменные процессы.
— Повышает работоспособность.
— Улучшает настроение.
Изготовитель: ООО «САНА» Декларация о соответствии: ТС № RU Д-RU.ПЩ01.В.10751 Сертификат соответствия: РОСС RU.АГ66.Н07510 625023, г.
 Тюмень, ул. Республики, д.169, к.1, оф.37 Тел. +7(3452)41-55-82 E-mail: [email protected]
Тюмень, ул. Республики, д.169, к.1, оф.37 Тел. +7(3452)41-55-82 E-mail: [email protected]Биологическая активность и терапевтический потенциал при хронических заболеваниях
Abstract
Растущий спрос на натуральные продукты в качестве альтернативной терапии хронических заболеваний стимулировал исследования фармакологической важности биологически активных соединений растений. В последнее время наблюдается всплеск интереса к терапевтическому потенциалу олеаноловой кислоты (ОА) в профилактике и лечении хронических заболеваний. Олеаноловая кислота представляет собой пентациклический тритерпеноид, широко встречающийся в растениях, включая фрукты и овощи, с использованием различных методов и хроматографических платформ для его экстракции и выделения.Несколько исследований продемонстрировали потенциальное терапевтическое воздействие ОА на различные заболевания и их симптомы. Кроме того, олеаноловая кислота также служит основой для разработки новых полусинтетических тритерпеноидов, которые могут оказаться жизненно важными для поиска терапевтических методов лечения различных заболеваний. Последние достижения в разработке и синтезе химических производных ОА позволяют повысить его растворимость, биодоступность и активность. Некоторые из этих производных также были терапевтическими кандидатами в ряде клинических испытаний.Этот обзор объединяет и расширяет недавние сообщения о биологических эффектах олеаноловой кислоты из различных растительных источников и ее синтетических производных, а также об их механизмах действия в моделях исследований in vitro и in vivo. Этот обзор предполагает, что олеаноловая кислота и ее производные являются важными кандидатами в поиске альтернативной терапии при лечении и лечении хронических заболеваний.
Последние достижения в разработке и синтезе химических производных ОА позволяют повысить его растворимость, биодоступность и активность. Некоторые из этих производных также были терапевтическими кандидатами в ряде клинических испытаний.Этот обзор объединяет и расширяет недавние сообщения о биологических эффектах олеаноловой кислоты из различных растительных источников и ее синтетических производных, а также об их механизмах действия в моделях исследований in vitro и in vivo. Этот обзор предполагает, что олеаноловая кислота и ее производные являются важными кандидатами в поиске альтернативной терапии при лечении и лечении хронических заболеваний.
Ключевые слова: олеаноловая кислота, сахарный диабет, хроматография, тритерпеноид, биологическая активность
1.Введение
Растения обычно используются в качестве альтернативного или дополнительного средства от хронических заболеваний, особенно в развивающихся странах [1]. Бесспорные терапевтические эффекты растений привлекли внимание исследователей в поисках биологически активных соединений, присутствующих в растениях и их продуктах. В нескольких исследованиях были выявлены различные фитохимические вещества растений, обладающие биологической активностью против хронических заболеваний. Олеаноловая кислота (ОА) — природный продукт, выделенный из ряда пищевых и лекарственных растений [2].Это пентациклический тритерпеноид, который в изобилии содержится в растениях семейства Oleaceae, таких как оливковое растение [3,4]. У этих растений ОА часто обнаруживают в эпикутикулярных восках, где они действуют как барьер против патогенов и потери воды [5]. Помимо его экологической роли в растениях, некоторые фармакологические действия, такие как антиоксидантное, противоопухолевое, противовоспалительное, антидиабетическое, противомикробное действие, приписываются ОА в различных моделях заболеваний [6,7,8, 9,10]. Олеаноловая кислота более 20 лет используется в качестве печеночного препарата в Китае из-за ее гепатопротекторного действия [11].Изучение других видов биологической активности ОА и его синтетических производных может привести к разработке сильнодействующих лекарств для лечения или лечения заболеваний человека.
В нескольких исследованиях были выявлены различные фитохимические вещества растений, обладающие биологической активностью против хронических заболеваний. Олеаноловая кислота (ОА) — природный продукт, выделенный из ряда пищевых и лекарственных растений [2].Это пентациклический тритерпеноид, который в изобилии содержится в растениях семейства Oleaceae, таких как оливковое растение [3,4]. У этих растений ОА часто обнаруживают в эпикутикулярных восках, где они действуют как барьер против патогенов и потери воды [5]. Помимо его экологической роли в растениях, некоторые фармакологические действия, такие как антиоксидантное, противоопухолевое, противовоспалительное, антидиабетическое, противомикробное действие, приписываются ОА в различных моделях заболеваний [6,7,8, 9,10]. Олеаноловая кислота более 20 лет используется в качестве печеночного препарата в Китае из-за ее гепатопротекторного действия [11].Изучение других видов биологической активности ОА и его синтетических производных может привести к разработке сильнодействующих лекарств для лечения или лечения заболеваний человека. В настоящее время в нашей лаборатории продолжаются исследования способности ОА уменьшать окислительный стресс и воспаление, вызванные высоким содержанием фруктозы, а также предотвращать метаболический синдром. Этот обзор объединяет последние сообщения о биологической активности олеаноловой кислоты и ее производных. В нем представлен обзор текущего состояния исследований потенциала олеаноловой кислоты в лечении хронических заболеваний.
В настоящее время в нашей лаборатории продолжаются исследования способности ОА уменьшать окислительный стресс и воспаление, вызванные высоким содержанием фруктозы, а также предотвращать метаболический синдром. Этот обзор объединяет последние сообщения о биологической активности олеаноловой кислоты и ее производных. В нем представлен обзор текущего состояния исследований потенциала олеаноловой кислоты в лечении хронических заболеваний.
1.1. Физическая и химическая природа олеаноловой кислоты и ее производных
Олеаноловая кислота представляет собой тритерпеноид, существующий в природе в виде свободной кислоты или агликона тритерпеноидных сапонинов, и часто встречается повсеместно в виде его изомера, усоловой кислоты [12]. Молекулярная формула и масса OA-C 30 H 48 O 3 и 456,70 г/моль соответственно [13]. Он также послужил основой для дополнительных модификаций для получения полусинтетических производных ОА для повышения эффективности, снижения токсичности, повышения биодоступности и растворимости [11,14,15]. Например, Ю и соавт. [15] разработали два новых пролекарства олеаноловой кислоты путем взаимодействия OA с 1,3-циклопропанилфосфатным эфиром. Свойство замедленного высвобождения сложных эфиров 1,3-циклопропана, придаваемое производным, улучшает биодоступность и продлевает срок хранения во время лечения. Химические модификации OA также привели к разработке ряда производных (), таких как 2-циано-3,12-диоксоолеана-1,9(11)-диен-28-овая кислота (CDDO), которая более чем в 200 000 раз более эффективен, чем исходная олеаноловая кислота [16].CDDO также был дополнительно химически модифицирован добавлением метильных групп с получением CDDO-MA (метиламид), CDDO-Me (метиловый эфир) и имидазола CDDO-Im (имидазол C28) [17]. Некоторые другие соединения, которые были синтезированы из OA, включают винилборонаты олеаноловой кислоты [18], сложные эфиры, оксимы и производные оксадиазола олеаноловой кислоты [19].
Например, Ю и соавт. [15] разработали два новых пролекарства олеаноловой кислоты путем взаимодействия OA с 1,3-циклопропанилфосфатным эфиром. Свойство замедленного высвобождения сложных эфиров 1,3-циклопропана, придаваемое производным, улучшает биодоступность и продлевает срок хранения во время лечения. Химические модификации OA также привели к разработке ряда производных (), таких как 2-циано-3,12-диоксоолеана-1,9(11)-диен-28-овая кислота (CDDO), которая более чем в 200 000 раз более эффективен, чем исходная олеаноловая кислота [16].CDDO также был дополнительно химически модифицирован добавлением метильных групп с получением CDDO-MA (метиламид), CDDO-Me (метиловый эфир) и имидазола CDDO-Im (имидазол C28) [17]. Некоторые другие соединения, которые были синтезированы из OA, включают винилборонаты олеаноловой кислоты [18], сложные эфиры, оксимы и производные оксадиазола олеаноловой кислоты [19].
Структуры олеаноловой кислоты и некоторых ее производных ( a ) Олеаноловая кислота] ( b ) CDDO ( c ) CDDO-Ma] ( d ) CDDO-Me ( e ) CDDO-Im [17].
1.2. Наличие олеаноловой кислоты в пищевых и лекарственных растениях
Пентациклические тритерпены, включая ОА, широко распространены в плодах, листьях и коре стеблей различных пищевых и лекарственных растений [20]. Лекарственные растения, такие как Lantana camara [21] и Lisgustrum lucidum [22], являются богатыми источниками олеаноловой кислоты и традиционно используются для лечения различных заболеваний. Выделение и характеристика олеаноловой кислоты были достигнуты на различных растениях, как показано на рис.OA можно легко получить с высоким выходом из оливкового растения, его основного коммерческого источника [23]. Гинда и его коллеги [24] сообщили, что содержание тритерпенов в листьях оливкового растения в основном зависит от сорта, при этом олеаноловая кислота является наиболее распространенным тритерпеноидом в исследованных сортах. Они также сообщили, что географическое происхождение, стадия развития и условия окружающей среды являются другими факторами, которые могут влиять на уровень олеаноловой кислоты в растениях. Обычные кулинарные специи, такие как тимьян и гвоздика, также являются источниками олеаноловой кислоты.Яблоко, мушмула, виноград, бузина и шалфей являются одними из плодовых растений, в которых также была обнаружена и выделена олеаноловая кислота [20,25].
Обычные кулинарные специи, такие как тимьян и гвоздика, также являются источниками олеаноловой кислоты.Яблоко, мушмула, виноград, бузина и шалфей являются одними из плодовых растений, в которых также была обнаружена и выделена олеаноловая кислота [20,25].
Таблица 1
Некоторые растительные источники олеаноловой кислоты.
| Растение Источники | Методы извлечения / растворители | Техника изоляции / растворители | Аналитические платформы | ||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EULEA EUROPAEA [33] | Maceration / 96% Ethanol | Кристаллизация и фильтрация | ГХ-ПИД*, ГХ-МС*, ДСК* | ||||||||||||||||||||||||||||||||||||||||||||||||
| Achyranthes aspera [34] | Непрерывная экстракция встряхиванием, микроволновая и ультразвуковая экстракция/метанол | NA | RP-UFLC-DAD *, FT-IR * | ||||||||||||||||||||||||||||||||||||||||||||||||
| Aspilia Africana [35] | Холодная мацерация/вода: метанол (30:70), последовательная экстракция водой и н -бутанолом | Колоночная хроматография на силикагеле/1CHCl 901 908 90 /MeOH (99:1) | ТСХ | ||||||||||||||||||||||||||||||||||||||||||||||||
| Monotheca Buxifolia [29] | Мацерация/метанол | Вакуумно-жидкостная хроматография и колонка Хроматография / N -Hexane, хлороформ и этилацетат | NMR | ||||||||||||||||||||||||||||||||||||||||||||||||
| Lantana Camara [21] | Разрядки с петролейным эфиром и мацерацией в этаноле | Осадки и кристаллизация / хлороформ и метанол соответственно | TLC, ВЭЖХ, IR * | ||||||||||||||||||||||||||||||||||||||||||||||||
| | [26] | [26] | [26] | [26] | [26] | [26] | Exxhlet Edvaction / нефтяной эфир, хлороформ, этилацетат и метанол | колоночная хроматография, тонкослойная хроматография | ЯМР, GCMS и IR | Ligustrum Lucidum [22] | Микроволновая печь для добычи / этанола, метанол, N -Butanol и Water | N / A | HPLC | Lugustrum Lucidum [27] | Ультразвуковая экстракция | N / A | ВЭЖХ | Ocimum Santum [28] | Микроволновая печь Извлечение из убов / этанол, метанол и вода | N / A | ВЭЖХ | Vitis Vinifera [36] | [36] | [36] | Окончатка / метанол и этилацетат | Силикагель-гелевая колоночная хроматография / этилацетат и N -Hexane | ЯМР, Ei-MS * | Flaveria Trinervia [37] | Извлечение SoxHlet / Chloroform | тонкий слой и колоночная хроматография / гексан и этилацетат | IR, 1 H-NMR | Syzygium Aromatomumum [38] | NS / гексан, дихлорметан, этилацетат и метанол | рекристаллизация / этанол | ¹H- и ¹³C-NMR | | Satureja MuTica [31] | Percolation / диэтиловый эфир | Колоночная хроматография на силикагеле/гексан, хлороформ, метанол, этилацетат | 1 H-ЯМР, 13 C-ЯМР и МС | Miconia albicans [39] | Мацерация/ n -гексан, метиленхлорид и этанол | Вакуумно-жидкостная хроматография/ n -гексан, этилацетат, этанол/и высокоэффективная жидкостная хроматография 0309/09040 , изопропиловый спирт | 1 Н-ЯМР, 13 С-ЯМР * | |
1.
 3. Экстракция, выделение и характеристика олеаноловой кислоты
3. Экстракция, выделение и характеристика олеаноловой кислоты Олеаноловая кислота была извлечена или выделена из различных растений с использованием таких методов экстракции, как экстракция по методу Сокслета [26], экстракция с помощью ультразвука [27] и экстракция с помощью микроволнового излучения [28]. Аналитическое оборудование, такое как тонкослойная хроматография (ТСХ) [21], высокоэффективная жидкостная хроматография (ВЭЖХ) [22, 27] и ядерный магнитный резонанс (ЯМР) [29], являются распространенными платформами, которые использовались для характеристики и идентификации ОА. .Выделение ОА обычно включает обезжиривание измельченного порошка растения неполярным растворителем, таким как н -гексан [30] или петролейный эфир [26]. За этим обычно следует подготовка неочищенных экстрактов и выделение олеаноловой кислоты с использованием таких методов, как осаждение и кристаллизация [21], вакуумная жидкостная хроматография [29] и колоночная хроматография [31]. Как и у большинства биоактивных веществ растений, ряд параметров также влияет на эффективность экстракции и выделения ОА. Некоторые из этих факторов включают выбор растворителей, концентрацию экстракционных растворителей, соотношение растворителей и растительного материала, температуру, продолжительность экстракции и метод экстракции/выделения [22,32]. Этими факторами обычно манипулируют для оптимизации выделения и извлечения ОА из различных растительных источников.
Некоторые из этих факторов включают выбор растворителей, концентрацию экстракционных растворителей, соотношение растворителей и растительного материала, температуру, продолжительность экстракции и метод экстракции/выделения [22,32]. Этими факторами обычно манипулируют для оптимизации выделения и извлечения ОА из различных растительных источников.
2. Биологическая активность олеаноловой кислоты и ее производных
2.1. Противоопухолевое/противораковое действие олеаноловой кислоты и ее производных
В ряде исследований сообщается о противоопухолевой и противораковой активности олеаноловой кислоты в отношении роста опухолей и рака в различных моделях in vitro и in vivo.Например, ОА ингибирует рост трансплантированной опухоли у мышей и пролиферацию гепатоцеллюлярных клеток печени (HepG2). Было высказано предположение, что противоопухолевое действие ОА связано с активацией опухолевого белка (р53), опосредованной циклооксигеназой-2 (ЦОГ-2) активацией митохондриального пути апоптоза и остановкой клеточного цикла [40]. С другой стороны, наблюдалась индукция гибели клеток при обработке комбинацией второго митохондриального активатора каспаз (SMAC), миметика BV6 и ОА в гепатоцеллюлярных клетках человека [41].
С другой стороны, наблюдалась индукция гибели клеток при обработке комбинацией второго митохондриального активатора каспаз (SMAC), миметика BV6 и ОА в гепатоцеллюлярных клетках человека [41].
SMAC-миметик BV6 является синтетическим селективным антагонистом белков-ингибиторов апоптоза (IAP) и, следовательно, также терапевтическим кандидатом при лечении рака [42]. Кроме того, при росте рака молочной железы, вызванном осмотическим стрессом, ОА обращал экспрессию гликолитических ферментов, которая ранее усиливалась гипертоническим состоянием. Это изменение эффективно привело к снижению пролиферации раковых клеток [43]. В клетках рака мочевого пузыря человека лечение 50 мкМ OA подавляло пролиферацию и усиливало апоптоз клеток посредством ингибирования передачи сигналов Akt/mTOR/S6K и ERK1/2 (пути, имеющие решающее значение для роста, пролиферации и выживания клеток) [44].
Другим предполагаемым специфическим механизмом противоопухолевого действия ОА является индукция сверхэкспрессии miR-122, белка, который, как было установлено, является важным супрессором опухоли при некоторых типах рака [45,46].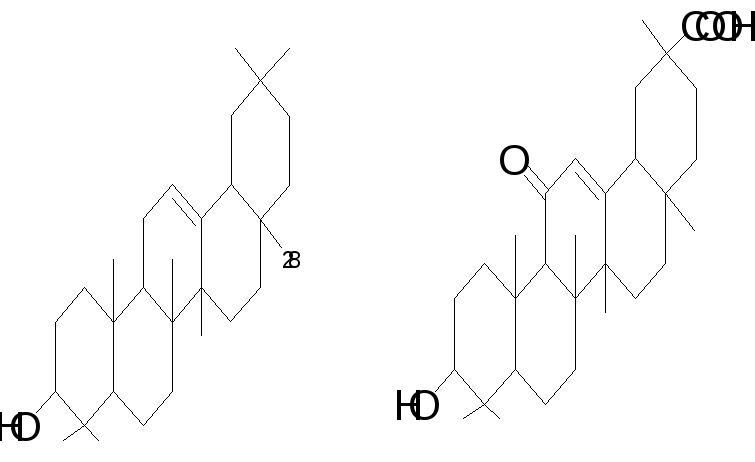 ОА индуцировал экспрессию миР-122 в клетках рака легкого до 9,9 раз после обработки 60 мкг/мл ОА в течение 8 часов [47].
ОА индуцировал экспрессию миР-122 в клетках рака легкого до 9,9 раз после обработки 60 мкг/мл ОА в течение 8 часов [47].
Метиловый эфир олеаноловой кислоты, производное ОА, также проявлял цитотоксическое действие на клетки рака шейки матки человека (HeLa) посредством индуцированного апоптоза и продукции активных форм кислорода в зависимости от концентрации и времени [14].Пытаясь повысить растворимость OA в воде, Ren et al. приготовили твердый комплекс включения OA с амино-присоединенными ß-циклодекстринами. Помимо значительного повышения растворимости, они зафиксировали повышенную цитотоксичность комплекса включения in vitro на линиях раковых клеток человека [48]. В целом эти исследования предполагают, что ОА и его производные могут быть ценными терапевтическими агентами против опухолей и рака благодаря их разнообразным механизмам действия.
2.2. Антидиабетическая активность
Диабет представляет собой сложное прогрессирующее заболевание, возникающее в результате нарушения секреции и/или чувствительности к инсулину [49,50,51]. Это связано с различными метаболическими осложнениями, которые поражают органы тела, такие как глаза, почки, кровеносные артерии и нервы [51,52]. Олеаноловая кислота использовалась в качестве терапевтического средства в моделях диабета для улучшения действия инсулина, ингибирования глюконеогенеза и стимуляции утилизации глюкозы. ОА не обладает адипогенной активностью в отличие от широко используемых противодиабетических препаратов, таких как инсулин или тиазолидиндионы, которые усиливают транспорт глюкозы на периферии и часто приводят к увеличению массы тела [53].Таким образом, ОА может оказаться многообещающим и лучшим терапевтическим методом без адипогенной активности, наблюдаемой у других антидиабетических или терапевтических средств против ожирения.
Это связано с различными метаболическими осложнениями, которые поражают органы тела, такие как глаза, почки, кровеносные артерии и нервы [51,52]. Олеаноловая кислота использовалась в качестве терапевтического средства в моделях диабета для улучшения действия инсулина, ингибирования глюконеогенеза и стимуляции утилизации глюкозы. ОА не обладает адипогенной активностью в отличие от широко используемых противодиабетических препаратов, таких как инсулин или тиазолидиндионы, которые усиливают транспорт глюкозы на периферии и часто приводят к увеличению массы тела [53].Таким образом, ОА может оказаться многообещающим и лучшим терапевтическим методом без адипогенной активности, наблюдаемой у других антидиабетических или терапевтических средств против ожирения.
Связь между резистентностью к инсулину и диабетом 2 типа давно признана и установлена [54]. Инсулинорезистентность является отличительной чертой диабета 2 типа и основным предиктором его возникновения [54,55]. В инсулинорезистентных клетках HepG2 лечение 25 мкмоль/л ОА улучшало чувствительность к инсулину за счет увеличения экспрессии белков субстрата 1 рецептора инсулина (IRS-1) и переносчика глюкозы 4 (GLUT-4) [56]. IRS1 является важным фактором в сигнальных путях инсулина, в то время как GLUT-4 является основным переносчиком глюкозы в скелетных мышцах, жировой ткани и печени и, следовательно, оба являются терапевтическими мишенями при лечении диабета [57]. В жировой ткани крыс введение 25 мг/кг/день добавки ОА в течение 10 недель также улучшало индуцированную фруктозой резистентность к инсулину через путь IRS-1/фосфатидилинозитол-3-киназа/Akt [58].
IRS1 является важным фактором в сигнальных путях инсулина, в то время как GLUT-4 является основным переносчиком глюкозы в скелетных мышцах, жировой ткани и печени и, следовательно, оба являются терапевтическими мишенями при лечении диабета [57]. В жировой ткани крыс введение 25 мг/кг/день добавки ОА в течение 10 недель также улучшало индуцированную фруктозой резистентность к инсулину через путь IRS-1/фосфатидилинозитол-3-киназа/Akt [58].
ОА также продемонстрировал свою способность ингибировать глюконеогенез и ослаблять резистентность печени к инсулину.Инсулинорезистентность печени при ожирении считается основным связующим звеном между диабетом 2 типа и неалкогольной жировой болезнью печени (НАЖБП) [59,60]. Лечение мышей с ожирением и диабетом дозой 20 мг/кг/день в течение 14 дней приводило к снижению массы тела, печени и жира, усилению передачи сигналов инсулина и ингибированию глюконеогенеза [7]. Точно так же один из результатов нашего исследования олеаноловой кислоты указывает на то, что раннее постнатальное введение ОА способно смягчить развитие НАЖБП у взрослых самок крыс, получавших фруктозу [61]. Эти данные также свидетельствуют о гепатопротекторном потенциале олеаноловой кислоты.
Эти данные также свидетельствуют о гепатопротекторном потенциале олеаноловой кислоты.
Гликогенфосфорилаза представляет собой фермент, который катализирует расщепление гликогена с высвобождением глюкозы в кровоток [62]. Его активность способствует выработке глюкозы в печени, и, следовательно, его ингибирование является важным подходом к контролю гипергликемии при диабете 2 типа [62,63]. Чжан и др. [64] разработали серию новых производных OA с длинными алкильными цепями или ароматическими кольцами в положении C3, чтобы усилить его гипогликемическую активность.Один из синтезированных рядов, 3β-{2-[4-(2-нафталин-1-ил)ацетоксиметил-1 H -1,2,3-триазол-1-ил]ацетокси}олеан-12-ен- 28-овая кислота (+) показала самую сильную активность в ингибировании гликогенфосфорилазы и усилении потребления глюкозы.
3β-{2-[4-(2-Нафталин-1-ил)ацетоксиметил-1 H -1,2,3-триазол-1-ил]ацетокси}олеан-12-ен-28-овая кислота (8 г) [64].
Комбинированная терапия желательна при лечении диабета 2 типа, чтобы предотвратить вторичную неудачу, которая иногда возникает при монотерапии [65,66]. Было показано, что ОА способен индуцировать синергетическое и дополнительное действие с другими противодиабетическими препаратами, такими как метформин и инсулин. Метформин — широко используемый препарат для лечения диабета 2 типа [67]. Чтобы оценить эффективность и синергизм комбинированной терапии ОА и метформина, эффект 250 мг/кг ОА в сочетании с 100 мг/кг метформина на мышах db/db (модель диабета и ожирения, где активность лептина рецептор недостаточен) был оценен Wang et al. [68].Мышей лечили в течение 4 недель и сравнивали с монотерапией каждым препаратом. Комбинированная терапия ОА и метформина значительно снижала уровень глюкозы и инсулина в крови и улучшала патологию печени по сравнению с монотерапией у мышей с диабетом. Аналогичным образом, в модели крыс с диабетом 1 типа 80 мг/кг ОА в синергии с 4 МЕ инсулина активировали ферменты в сигнальном каскаде инсулина и усиливали стимулированную инсулином гипогликемическую активность [69]. Эти данные свидетельствуют о том, что ОА может найти применение в качестве компонента комбинированной терапии сахарного диабета 2 типа.
Было показано, что ОА способен индуцировать синергетическое и дополнительное действие с другими противодиабетическими препаратами, такими как метформин и инсулин. Метформин — широко используемый препарат для лечения диабета 2 типа [67]. Чтобы оценить эффективность и синергизм комбинированной терапии ОА и метформина, эффект 250 мг/кг ОА в сочетании с 100 мг/кг метформина на мышах db/db (модель диабета и ожирения, где активность лептина рецептор недостаточен) был оценен Wang et al. [68].Мышей лечили в течение 4 недель и сравнивали с монотерапией каждым препаратом. Комбинированная терапия ОА и метформина значительно снижала уровень глюкозы и инсулина в крови и улучшала патологию печени по сравнению с монотерапией у мышей с диабетом. Аналогичным образом, в модели крыс с диабетом 1 типа 80 мг/кг ОА в синергии с 4 МЕ инсулина активировали ферменты в сигнальном каскаде инсулина и усиливали стимулированную инсулином гипогликемическую активность [69]. Эти данные свидетельствуют о том, что ОА может найти применение в качестве компонента комбинированной терапии сахарного диабета 2 типа.
Ингибирование ферментов метаболизма углеводов является важной стратегией контроля постпрандиальной гипергликемии при диабете 2 типа [70,71]. Кастеллано и др. [33] выделили ОА из листьев оливкового растения и исследовали его способность ингибировать ферменты α-амилазы и α-глюкозидазы. В исследовании сообщалось, что ОА проявляет сильное ингибирование альфа-глюкозидазы. Учитывая доказательства антидиабетического потенциала ОА за счет многочисленных взаимодополняющих механизмов, ОА и его производные предлагают многообещающую альтернативную терапию при лечении диабета.
2.3. Антимикробная активность
Олеаноловая кислота играет роль в защите растений от патогенов [4]. Следовательно, ожидается, что ОА будет обладать антимикробной активностью в отношении широкого круга патогенов. У людей антибактериальная терапия часто используется для лечения вторичных инфекций, иногда возникающих в результате осложнений хронических заболеваний [72]. Более того, патогены стали заметными факторами не только осложнений, но и прогрессирования хронических заболеваний [73]. Например, ОА проявлял противомикробное действие против Listeria monocytogenes , Enterococcus faecalis и Enterococcus faecium , повреждая их клеточные мембраны [74]. Чтобы дополнительно охарактеризовать функцию ОА у других микроорганизмов, вызывающих различные заболевания, из околоплодника лекарственного пищевого растения Akebia trifoliate отдельно выделили ряд соединений олеанановых тритерпеноидов, включая олеаноловую кислоту и эпиолеаноловую кислоту [75].Антибактериальную активность каждого из этих соединений оценивали в отношении пяти штаммов бактерий. Олеаноловая кислота проявляла умеренную активность в отношении Staphyloccus aureus и Bacillus thuringiensis при 62,5 мкг/мл и Escherichia coli , Salmonella enterica и Shigella dysenteriae при 31,2 мкг/мл. С другой стороны, 3-эпиолеаноловая кислота проявляла более сильную антибактериальную активность в диапазоне МИК (0.9–7,8 мкг/мл), что близко по сравнению с положительным эталоном (сульфат канамицина) с диапазоном МИК 1,9–3,9 мкг/мл.
Например, ОА проявлял противомикробное действие против Listeria monocytogenes , Enterococcus faecalis и Enterococcus faecium , повреждая их клеточные мембраны [74]. Чтобы дополнительно охарактеризовать функцию ОА у других микроорганизмов, вызывающих различные заболевания, из околоплодника лекарственного пищевого растения Akebia trifoliate отдельно выделили ряд соединений олеанановых тритерпеноидов, включая олеаноловую кислоту и эпиолеаноловую кислоту [75].Антибактериальную активность каждого из этих соединений оценивали в отношении пяти штаммов бактерий. Олеаноловая кислота проявляла умеренную активность в отношении Staphyloccus aureus и Bacillus thuringiensis при 62,5 мкг/мл и Escherichia coli , Salmonella enterica и Shigella dysenteriae при 31,2 мкг/мл. С другой стороны, 3-эпиолеаноловая кислота проявляла более сильную антибактериальную активность в диапазоне МИК (0.9–7,8 мкг/мл), что близко по сравнению с положительным эталоном (сульфат канамицина) с диапазоном МИК 1,9–3,9 мкг/мл.
Туберкулез (ТБ) является потенциально хроническим заболеванием, вызываемым бациллой Mycobacterium tuberculosis , и является одной из ведущих причин смерти в развивающихся странах [76]. Лекарственная устойчивость представляет собой серьезную угрозу для контроля и лечения ТБ, и одной из стратегий, используемых для преодоления лекарственной устойчивости, является использование комбинированной терапии [77]. Хименес-Арелланес и др.[78] объединили OA с его изомером, урсоловой кислотой (UA), чтобы определить их синергетическую антибактериальную активность против Mycobacterium tuberculosis h47Rv и лекарственно-резистентного клинического штамма (MDR) туберкулеза в клеточных линиях макрофагов и зараженных туберкулезом мышей BALB/C. В исследовании оценивали нагрузку легочных бацилл и уровни экспрессии интерферона-γ (IFN-γ), фактора некроза опухоли-α (TNF-α) и индуцибельной синтазы оксида азота (iNOS). Хотя ОА и УК по отдельности проявляли антимикобактериальную активность, наблюдалась также синергическая внутриклеточная активность смеси обоих соединений против штаммов туберкулеза в клеточных линиях макрофагов. У инфицированных мышей BALB/C наблюдалось значительное снижение количества легочных бацилл при лечении обоими соединениями. Кроме того, наблюдалось увеличение экспрессии iNOS и цитокинов; TNF-α и IFN-γ, что позволяет предположить, что ОА в сочетании с UA также обладают иммуномодулирующим действием, которое можно использовать для борьбы с туберкулезом и, возможно, другими заболеваниями.
У инфицированных мышей BALB/C наблюдалось значительное снижение количества легочных бацилл при лечении обоими соединениями. Кроме того, наблюдалось увеличение экспрессии iNOS и цитокинов; TNF-α и IFN-γ, что позволяет предположить, что ОА в сочетании с UA также обладают иммуномодулирующим действием, которое можно использовать для борьбы с туберкулезом и, возможно, другими заболеваниями.
Имеются также сообщения о производных OA, которые были разработаны и оценены как потенциальные терапевтические средства для борьбы с микробными заболеваниями.Например, 25 производных оксимового эфира OA были разработаны и синтезированы Zhao et al. [11] для изучения их противогрибковой активности. Все производные показали более сильную противогрибковую активность, чем «исходный» ОА, в отношении Sclerotinia sclerotiorum и Rhizoctonia solani в концентрации 50 мкг/мл. Однако они показали гораздо меньшее ингибирование глюкозамин-6-фосфатсинтазы (молекулярная мишень противогрибковых средств), чем «исходное» соединение ОА.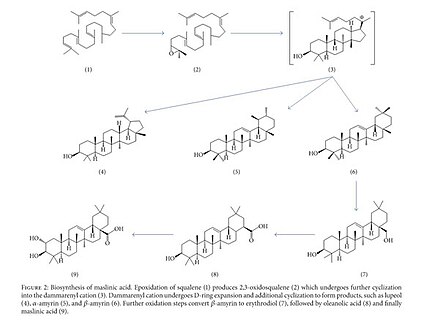
2.4. Гепатозащитная способность
Печень является важнейшим органом в метаболической деятельности организма, особенно при модификации лекарственных препаратов в соответствии с потребностями организма. В наши дни люди потребляют много лекарств в день, что подвергает печень цитотоксичности. Одной из заметных биоактивностей ОА является защита печени от токсичности, и в настоящее время он используется в качестве безрецептурного печеночного препарата в Китае [11]. У крыс-альбиносов линии Вистар использовали ОА из Flaveria trinervia , который оказывал значительный защитный эффект в отношении индуцированной этанолом токсичности печени, восстанавливая уровни гепатотоксических маркерных ферментов в сыворотке [37].Это исследование предложило антиоксидантную способность ОА как еще один возможный механизм его гепатозащитной способности. Комбинированная терапия как средство повышения эффективности лекарственных средств нашла широкое применение в лечении различных заболеваний. Гутьеррес-Реболледо и др. [79] оценивали влияние ОА в комбинированной терапии с УК на индуцированное противотуберкулезными препаратами поражение печени. Гепатотоксичность была признана сильным побочным эффектом противотуберкулезного препарата [80,81]. Введение 100 и 200 мкг/мышь/сут смеси ОА и УК предотвращало стеатоз, вызванный противотуберкулезными препаратами, с лучшим эффектом при лечении 100 мкг/мышь/сут.
Гутьеррес-Реболледо и др. [79] оценивали влияние ОА в комбинированной терапии с УК на индуцированное противотуберкулезными препаратами поражение печени. Гепатотоксичность была признана сильным побочным эффектом противотуберкулезного препарата [80,81]. Введение 100 и 200 мкг/мышь/сут смеси ОА и УК предотвращало стеатоз, вызванный противотуберкулезными препаратами, с лучшим эффектом при лечении 100 мкг/мышь/сут.
В попытке изменить метаболизм ОА и, следовательно, продлить его срок годности во время лечения, Yu et al. [15] разработали два новых пролекарства ОА (). Помимо оценки метаболизма и биораспределения у крыс, гепатозащитная способность производных была также исследована против индуцированного четыреххлористым углеродом (CCl 4 ) поражения печени у мышей. Повышенный уровень сывороточных печеночных ферментов, вызванный лечением CCl 4 , значительно снижался при лечении пролекарствами.Кроме того, повышенный уровень малонового альдегида и сниженная активность антиоксидантных ферментов (GPx и SOD), которые также являются индикаторами повреждения печени, были обращены вспять у мышей, получавших синтезированные производные ОА. Исследование показало, что пролекарства не только имеют улучшенный период полураспада, но также обладают сильными гепатопротекторными и антиоксидантными свойствами.
Исследование показало, что пролекарства не только имеют улучшенный период полураспада, но также обладают сильными гепатопротекторными и антиоксидантными свойствами.
Два новых пролекарства олеаноловой кислоты: ( a ) цис -3- O -[4-( R )-(3-хлорфенил)-2-оксо-1,3,2-диоксафосфоринан- 2-ил]-олеаноловая кислота ( b ) цис -3- O -[4-( S )-(3-хлорфенил)-2-оксо-1,3,2-диокса-фосфоринан -2-ил]олеаноловая кислота [15].
2.5. Антигипертензивные эффекты
Артериальная гипертензия — хроническое заболевание, поражающее многих людей как в развивающихся, так и в развитых странах, характеризующееся хроническим повышением системного артериального давления выше определенного порогового значения [82]. Альтернативная терапия растениями желательна для лечения гипертонии, поскольку доступные синтетические препараты связаны с побочными эффектами и вторичной неудачей [83]. Хотя и ограниченный, имеется ряд антигипертензивных сообщений об ОА и его производных. Например, профилактический эффект ОА в дозе 60 мг/кг на вызванную глюкокортикоидами гипертензию у крыс оценивали Bachhav et al. [84]. Применение олеаноловой кислоты достоверно предотвращало повышение систолического артериального давления и уровня перекисного окисления липидов в сердце. Тем не менее, не было значительного влияния на изменения массы тела и тимуса, которые ранее были вызваны лечением глюкокортикоидами. В исследовании предполагалось возможное участие высвобождающего оксид азота (NO) действия ОА в его антигипертензивном эффекте.NO — это молекула, которая, как известно, играет важную роль в системе регуляции сердечно-сосудистой системы [85,86]. Чтобы лучше понять механизм гипотензивного эффекта ОА и участия NO, крыс с гипертензией, индуцированной Nω-нитро-L-аргинин метиловым эфиром (L-NAME), у которых NO был полностью заблокирован, лечили ОА [87]. Лечение ОА привело к незначительному увеличению уровня NO x . Однако этого недостаточно, чтобы указать на участие NO в гипотензивном эффекте ОА, и было высказано предположение, что измерение уровня экспрессии синтазы оксида азота (NOS) может дать лучшее и более глубокое представление о способности высвобождать NO.
Например, профилактический эффект ОА в дозе 60 мг/кг на вызванную глюкокортикоидами гипертензию у крыс оценивали Bachhav et al. [84]. Применение олеаноловой кислоты достоверно предотвращало повышение систолического артериального давления и уровня перекисного окисления липидов в сердце. Тем не менее, не было значительного влияния на изменения массы тела и тимуса, которые ранее были вызваны лечением глюкокортикоидами. В исследовании предполагалось возможное участие высвобождающего оксид азота (NO) действия ОА в его антигипертензивном эффекте.NO — это молекула, которая, как известно, играет важную роль в системе регуляции сердечно-сосудистой системы [85,86]. Чтобы лучше понять механизм гипотензивного эффекта ОА и участия NO, крыс с гипертензией, индуцированной Nω-нитро-L-аргинин метиловым эфиром (L-NAME), у которых NO был полностью заблокирован, лечили ОА [87]. Лечение ОА привело к незначительному увеличению уровня NO x . Однако этого недостаточно, чтобы указать на участие NO в гипотензивном эффекте ОА, и было высказано предположение, что измерение уровня экспрессии синтазы оксида азота (NOS) может дать лучшее и более глубокое представление о способности высвобождать NO. ОА.Другие параметры, такие как уменьшение объема мочи, содержание натрия и калия в моче и повышение уровня креатинина в сыворотке, вызванное лечением L-NAME, были значительно изменены при ОА. В исследовании сделан вывод о том, что защитный эффект ОА при гипертензии, вызванной L-NAME, может быть обусловлен диурезом и нефропротекцией.
ОА.Другие параметры, такие как уменьшение объема мочи, содержание натрия и калия в моче и повышение уровня креатинина в сыворотке, вызванное лечением L-NAME, были значительно изменены при ОА. В исследовании сделан вывод о том, что защитный эффект ОА при гипертензии, вызванной L-NAME, может быть обусловлен диурезом и нефропротекцией.
Более глубокое понимание гипотензивного эффекта ОА было получено в исследовании, проведенном Madlala et al. [88] об ОА и его производных; метиловый эфир ОА (Ме-ОА) и бромированный ОА (Br-ОА).Эти соединения проявляли сосудорасширяющее действие, которому способствовали как эндотелийзависимые, так и независимые механизмы, включающие ЦОГ и сосудистые мышечные каналы K + соответственно.
2.6. Антиоксидантная активность
Известно, что окислительный стресс участвует в патогенезе различных хронических заболеваний, поэтому антиоксидантная терапия является многообещающей стратегией лечения этих заболеваний [89]. Сообщения о биологической активности ОА иногда связывают с его антиоксидантным действием. Например, было показано, что олеаноловая кислота из Ligustrum lucidum снижает уровень малонового альдегида (МДА) и увеличивает активность супероксиддисмутазы (СОД) и глутатионпероксидазы (GSH-px) у крыс с аллоксан-индуцированным диабетом [90]. Уровень MDA (побочный продукт перекисного окисления липидов), активность SOD и GPX (ключевых антиоксидантных ферментов) являются важными детерминантами антиоксидантного статуса в тканях млекопитающих [91]. Точно так же в исследовании in vitro ОА увеличивал выработку глутатиона и экспрессию ключевых антиоксидантных ферментов [6].Кроме того, антиоксидантные свойства ОА, выделенного из кожуры винограда, оценивали с использованием анализов антиоксидантной способности, восстанавливающей железо (FRAP), 1,1-дифенил-2-пикрилгидразила (DPPH) и ингибирования перекисного окисления липидов. В этом исследовании выделенный OA продемонстрировал антиоксидантные свойства, сравнимые с коммерческими антиоксидантными агентами [36].
Например, было показано, что олеаноловая кислота из Ligustrum lucidum снижает уровень малонового альдегида (МДА) и увеличивает активность супероксиддисмутазы (СОД) и глутатионпероксидазы (GSH-px) у крыс с аллоксан-индуцированным диабетом [90]. Уровень MDA (побочный продукт перекисного окисления липидов), активность SOD и GPX (ключевых антиоксидантных ферментов) являются важными детерминантами антиоксидантного статуса в тканях млекопитающих [91]. Точно так же в исследовании in vitro ОА увеличивал выработку глутатиона и экспрессию ключевых антиоксидантных ферментов [6].Кроме того, антиоксидантные свойства ОА, выделенного из кожуры винограда, оценивали с использованием анализов антиоксидантной способности, восстанавливающей железо (FRAP), 1,1-дифенил-2-пикрилгидразила (DPPH) и ингибирования перекисного окисления липидов. В этом исследовании выделенный OA продемонстрировал антиоксидантные свойства, сравнимые с коммерческими антиоксидантными агентами [36].
2.7. Противовоспалительный потенциал
Воспаление играет ключевую роль в развитии и прогрессировании различных заболеваний, таких как резистентность к инсулину и диабет [92], рак [93] и астма [94].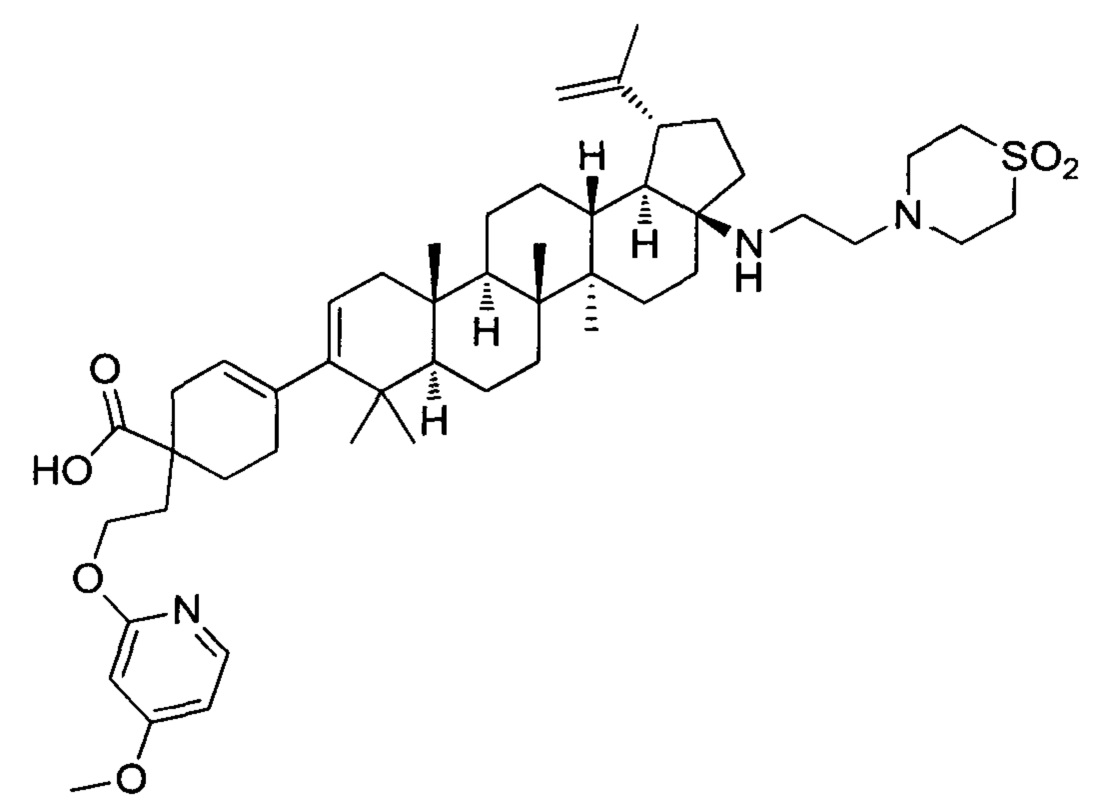 Было показано, что в эндотелиальных клетках пупочной вены человека (HUVEC) ОА обладает противовоспалительными свойствами за счет ингибирования высвобождения липосахаридов (LPS), опосредованной экспрессией высокоподвижной групповой коробки 1 (HMGB1) и молекул клеточной адгезии (CAMs) [95]. HMGBI — это белок, который активирует провоспалительные цитокины при некоторых воспалительных заболеваниях [96]. Точно так же Ли и соавт. [97] сообщили, что ОА смягчал индуцированные ЛПС провоспалительные реакции за счет снижения экспрессии ядерного фактора-κB (NF-κB) и фактора некроза опухоли-α (TNF-α) (биомаркеров воспаления) in vivo. и исследования in vitro.
Было показано, что в эндотелиальных клетках пупочной вены человека (HUVEC) ОА обладает противовоспалительными свойствами за счет ингибирования высвобождения липосахаридов (LPS), опосредованной экспрессией высокоподвижной групповой коробки 1 (HMGB1) и молекул клеточной адгезии (CAMs) [95]. HMGBI — это белок, который активирует провоспалительные цитокины при некоторых воспалительных заболеваниях [96]. Точно так же Ли и соавт. [97] сообщили, что ОА смягчал индуцированные ЛПС провоспалительные реакции за счет снижения экспрессии ядерного фактора-κB (NF-κB) и фактора некроза опухоли-α (TNF-α) (биомаркеров воспаления) in vivo. и исследования in vitro.
Миокардит — воспалительное заболевание сердечной мышцы, которое может прогрессировать в хроническую сердечную недостаточность [98]. Противовоспалительный эффект ОА также был продемонстрирован на мышах с экспериментальным аутоиммунным миокардитом, где он способствовал выработке противовоспалительных цитокинов, снижал выработку провоспалительных цитокинов и, в конечном итоге, облегчал другие симптомы заболевания [99]. Кроме того, способность ОА ослаблять резистентность печени к инсулину у мышей db/db частично объясняется его противовоспалительной активностью, о чем свидетельствует снижение уровней IL-1β, IL-6 и TNFα в печени мышей db/db. мышей при лечении ОА [7].
Кроме того, способность ОА ослаблять резистентность печени к инсулину у мышей db/db частично объясняется его противовоспалительной активностью, о чем свидетельствует снижение уровней IL-1β, IL-6 и TNFα в печени мышей db/db. мышей при лечении ОА [7].
Производное олеаноловой кислоты, метил-3-октаноилоксииминоолеан-12-ен-28-оат, также показало противовоспалительную активность, о чем свидетельствуют его противоотечные эффекты у крыс с индуцированным каррагинаном воспалением кожи [100]. Эти данные свидетельствуют о том, что олеаноловая кислота и ее производные являются многообещающими терапевтическими кандидатами, которые можно исследовать при лечении заболеваний, связанных с воспалением.
2.8. Антипаразитарная активность
Широко сообщалось об этиологической причастности паразитарных инфекций (особенно при отсутствии лечения) к хроническим заболеваниям [101].Например, лейшманиоз, паразитарная инфекция, вызываемая видом Leishmani a, может перейти в хроническую форму при отсутствии надлежащего лечения [102]. Исследовали активность ОА против амастигот стадии Leishmania (L.) infantum и Leishmania (L.) amazonensis в сравнении с маслиновой кислотой (другой природный тритерпеноид). В исследовании сообщается, что, хотя маслиновая кислота показала лучшую активность против L. amazonensis , олеаноловая кислота показала относительно более высокую активность против L.infantum с IC 50 0,999 ± 0,089 мкг/мл и индексом селективности 8,111 [103]. Аналогичным образом олеаноловая кислота проявляла антилейшманиозную активность в отношении L. amazonensis , L. braziliensis и L. infantum, , возбудителей трех клинических форм лейшманиоза. Их механистическое исследование показало, что ОА может взаимодействовать со стерол-14-α-деметилазой (CYP51) (терапевтическая мишень при лейшманиозе) и сдерживать ее окислительную активность [104].
Исследовали активность ОА против амастигот стадии Leishmania (L.) infantum и Leishmania (L.) amazonensis в сравнении с маслиновой кислотой (другой природный тритерпеноид). В исследовании сообщается, что, хотя маслиновая кислота показала лучшую активность против L. amazonensis , олеаноловая кислота показала относительно более высокую активность против L.infantum с IC 50 0,999 ± 0,089 мкг/мл и индексом селективности 8,111 [103]. Аналогичным образом олеаноловая кислота проявляла антилейшманиозную активность в отношении L. amazonensis , L. braziliensis и L. infantum, , возбудителей трех клинических форм лейшманиоза. Их механистическое исследование показало, что ОА может взаимодействовать со стерол-14-α-деметилазой (CYP51) (терапевтическая мишень при лейшманиозе) и сдерживать ее окислительную активность [104].
2.9. Олеаноловая кислота и ее производные в клинических испытаниях
Ряд производных ОА были кандидатами на фазах клинических испытаний для определения их безопасности, дозировки, побочных эффектов и фармакокинетических профилей. Наиболее популярным производным ОА в клинических испытаниях является бардоксолон метил (CDDO-Me). CDDO-Me оценивался в клинических испытаниях, фаза 1, для прогрессирующих солидных опухолей и лимфомы у 47 пациентов Hong et al. [105]. Бардоксолон метил назначали перорально 1 раз в сутки в течение 21 дня 28-дневного цикла в начальной дозе 5 мг/сут.CDDO-Me хорошо переносился пациентами при максимально переносимой дозе (МПД) 900 мг/сут. Кроме того, он показал противоопухолевую активность, активируя NRF2 (фактор транскрипции, традиционно считающийся супрессором опухоли) в мононуклеарных клетках периферической крови (PBMC) и ингибируя NF-κB и циклин D1 (медиатор прогрессирования клеточного цикла) в биоптатах опухоли. Расчетная скорость клубочковой фильтрации (рСКФ, мера почечной функции) у пациентов также была увеличена, и это указывает на то, что CDDO-Me может играть роль в лечении хронического заболевания почек.Наиболее частыми побочными эффектами были утомляемость, тошнота и анорексия, которые наблюдались у 40%, 34% и 30% пациентов соответственно.
Наиболее популярным производным ОА в клинических испытаниях является бардоксолон метил (CDDO-Me). CDDO-Me оценивался в клинических испытаниях, фаза 1, для прогрессирующих солидных опухолей и лимфомы у 47 пациентов Hong et al. [105]. Бардоксолон метил назначали перорально 1 раз в сутки в течение 21 дня 28-дневного цикла в начальной дозе 5 мг/сут.CDDO-Me хорошо переносился пациентами при максимально переносимой дозе (МПД) 900 мг/сут. Кроме того, он показал противоопухолевую активность, активируя NRF2 (фактор транскрипции, традиционно считающийся супрессором опухоли) в мононуклеарных клетках периферической крови (PBMC) и ингибируя NF-κB и циклин D1 (медиатор прогрессирования клеточного цикла) в биоптатах опухоли. Расчетная скорость клубочковой фильтрации (рСКФ, мера почечной функции) у пациентов также была увеличена, и это указывает на то, что CDDO-Me может играть роль в лечении хронического заболевания почек.Наиболее частыми побочными эффектами были утомляемость, тошнота и анорексия, которые наблюдались у 40%, 34% и 30% пациентов соответственно. Однако в ходе испытания не было отмечено опасных для жизни побочных эффектов, связанных с CDDO-Me.
Однако в ходе испытания не было отмечено опасных для жизни побочных эффектов, связанных с CDDO-Me.
Кроме того, CDDO-Me оценивали в исследовании фазы 2 для лечения хронической болезни почек (ХБП), связанной с диабетом 2 типа, у 227 пациентов. В исследовании лечение бардоксолоном метилом в течение 52 недель привело к значительному улучшению рСКФ у пациентов. Также наблюдалось устойчивое повышение рСКФ в течение 4 недель после прекращения лечения бардоксолоном метил; исследование предположило, что это может быть связано с уменьшением воспаления и окислительного стресса, связанных с ХБП.Побочными эффектами у пациентов были мышечный спазм, умеренное повышение уровня аланинаминотрансферазы и желудочно-кишечные эффекты, которые обычно прекращались без отмены препарата [106]. Однако безопасность бардоксолона метила (CDDO-Me) стала сомнительной, когда у пациентов, получавших препарат в исследовании фазы 3, развились побочные эффекты, связанные с сердцем, что привело к остановке исследования [107]. Тем не менее, CDDO-Me в настоящее время оценивается в клинических исследованиях фазы 3, чтобы определить его эффективность в качестве безопасного терапевтического средства для лечения легочной артериальной гипертензии, связанной с заболеванием соединительной ткани [108].
Тем не менее, CDDO-Me в настоящее время оценивается в клинических исследованиях фазы 3, чтобы определить его эффективность в качестве безопасного терапевтического средства для лечения легочной артериальной гипертензии, связанной с заболеванием соединительной ткани [108].
Олеаноловая кислота — ScienceDirect
https://doi.org/10.1016/j.phytochem.2011.12.022Get rights and content тритерпеноидное соединение, широко распространенное в растительном мире. В природе соединение существует либо в виде свободной кислоты, либо в виде предшественника агликона для тритерпеноидных сапонинов, в которых оно может быть связано с одной или несколькими сахарными цепями. Олеаноловая кислота и ее производные обладают несколькими многообещающими фармакологическими свойствами, такими как гепатопротекторное действие, противовоспалительное, антиоксидантное или противораковое действие.С недавним выяснением его биосинтеза и предстоящей коммерциализацией первого препарата, полученного из олеаноловой кислоты, соединение обещает оставаться важным для различных исследований.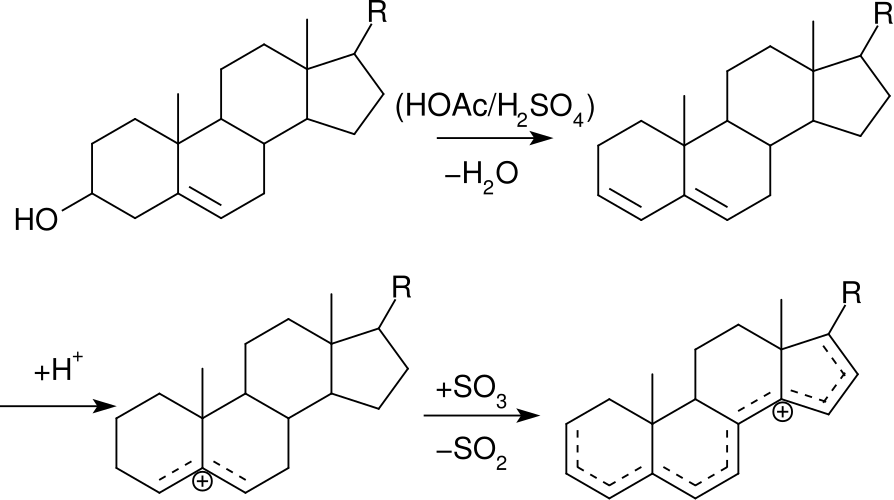 В этом обзоре обсуждаются недавние успехи в понимании биосинтеза олеаноловой кислоты и ее фармакологии. Кроме того, подчеркивается важность и потенциальное применение синтетических производных олеаноловой кислоты, а также приводятся перспективы исследований олеаноловой кислоты.
В этом обзоре обсуждаются недавние успехи в понимании биосинтеза олеаноловой кислоты и ее фармакологии. Кроме того, подчеркивается важность и потенциальное применение синтетических производных олеаноловой кислоты, а также приводятся перспективы исследований олеаноловой кислоты.Графический реферат
Олеаноловая кислота (3β-гидроксиолеан-12-ен-28-овая кислота) представляет собой пентациклическое тритерпеноидное соединение с различной фармакологической активностью и широко распространено в царстве растений.
- Загрузить : Загрузить изображение с полным размером
Основные моменты
► Олеаноловая кислота представляет собой тритерпеноидное соединение, присутствующее во многих видах растений. ► Выяснен полный путь биосинтеза, ведущий к олеаноловой кислоте. ► Олеаноловая кислота оказывает фармакологическую активность, например, гепатопротекторное действие. ► Химические производные олеаноловой кислоты обладают повышенной фармакологической активностью. ► Перспективы гетерологичного биосинтеза олеаноловой кислоты и ее производных.
► Перспективы гетерологичного биосинтеза олеаноловой кислоты и ее производных.
ключевые слова
ключевые слова
CDDO-ME
CDDO-ME
Bardoxolone Метил
GC-MS
NRF2
Synthetic Triterpenes
Saponins
Гепатозащита
Противовоспалительная
Anticancer
Рекомендуемая статьи (0)
Просмотреть полный текстCopyright © 2012 Elsevier Ltd. Все права защищены.
Рекомендуемые статьи
Ссылки на статьи
Разработка и оценка лекарственных форм олеаноловой кислоты и ее производных
Олеаноловая кислота представляет собой пентациклическое тритерпеноидное соединение, которое широко встречается в лекарственных травах и других растениях.Из-за обширной фармакологической активности олеаноловая кислота привлекает все больше и больше внимания. Однако структурные характеристики олеаноловой кислоты препятствуют прямому превращению ее в новые лекарства, что ограничивает применение олеаноловой кислоты. Благодаря применению современных технологий и методов приготовления были разработаны и синтезированы различные лекарственные формы и производные олеаноловой кислоты. Эти методы могут улучшить растворимость в воде и биодоступность олеаноловой кислоты и заложить основу для разработки новых лекарств.В этом обзоре обсуждается недавний прогресс в понимании лекарственных форм олеаноловой кислоты и ее производных. Кроме того, эти продукты были всесторонне оценены с точки зрения характеристик и фармакокинетики, и эта работа может предоставить идеи и ссылки для разработки препаратов олеаноловой кислоты.
Благодаря применению современных технологий и методов приготовления были разработаны и синтезированы различные лекарственные формы и производные олеаноловой кислоты. Эти методы могут улучшить растворимость в воде и биодоступность олеаноловой кислоты и заложить основу для разработки новых лекарств.В этом обзоре обсуждается недавний прогресс в понимании лекарственных форм олеаноловой кислоты и ее производных. Кроме того, эти продукты были всесторонне оценены с точки зрения характеристик и фармакокинетики, и эта работа может предоставить идеи и ссылки для разработки препаратов олеаноловой кислоты.
1. Введение
Олеаноловая кислота (ОА, рис. 1) относится к пентациклическим тритерпенам олеананового типа, широко распространенным почти в 200 видах растений, включая Swertia, Ligustrum lucidum, виноград и бузину [1].Многие исследования показали, что олеаноловая кислота обладает фармакологическими эффектами защиты печени, антиоксидантными, гиполипидемическими, противоопухолевыми, противовоспалительными и противовирусными эффектами [2-6]. Однако из-за плохой растворимости в воде и низкой биодоступности при пероральном приеме разработка олеаноловой кислоты в области фармацевтики ограничена, и ее терапевтический эффект также трудно проявить в полной мере [7]. В этой статье, путем обзора технологии получения олеаноловой кислоты в стране и за рубежом в последние годы, обнаружено, что существуют в основном два способа улучшить растворимость в воде, проницаемость и биодоступность олеаноловой кислоты.Одним из них является получение новых лекарственных форм олеаноловой кислоты, таких как наночастицы, липосомы, твердые дисперсии и фосфолипидные комплексы, для улучшения растворения, проникновения и абсорбции олеаноловой кислоты [8]. Другой заключается в модификации молекулярной формулы олеаноловой кислоты для получения более биоактивных и экстенсивных производных, которые являются основой для разработки новых лекарственных средств [9].
Однако из-за плохой растворимости в воде и низкой биодоступности при пероральном приеме разработка олеаноловой кислоты в области фармацевтики ограничена, и ее терапевтический эффект также трудно проявить в полной мере [7]. В этой статье, путем обзора технологии получения олеаноловой кислоты в стране и за рубежом в последние годы, обнаружено, что существуют в основном два способа улучшить растворимость в воде, проницаемость и биодоступность олеаноловой кислоты.Одним из них является получение новых лекарственных форм олеаноловой кислоты, таких как наночастицы, липосомы, твердые дисперсии и фосфолипидные комплексы, для улучшения растворения, проникновения и абсорбции олеаноловой кислоты [8]. Другой заключается в модификации молекулярной формулы олеаноловой кислоты для получения более биоактивных и экстенсивных производных, которые являются основой для разработки новых лекарственных средств [9].
В этой статье мы обобщили и оценили различные лекарственные формы и производные олеаноловой кислоты. Показатели оценки в основном включают растворимость, биодоступность, цитотоксичность и биологический период полураспада. Целью данного исследования является предоставление справочных материалов для исследований препаратов олеаноловой кислоты и последующих исследований.
Показатели оценки в основном включают растворимость, биодоступность, цитотоксичность и биологический период полураспада. Целью данного исследования является предоставление справочных материалов для исследований препаратов олеаноловой кислоты и последующих исследований.
2. Фармакологические эффекты ОА и его производных
2.1. Гепатопротекторный эффект
Гепатопротекторный эффект олеаноловой кислоты делает ее полезной в качестве безрецептурного перорального препарата в Китае для лечения людей при заболеваниях печени. Олеаноловая кислота оказывает защитное действие не только на острое химическое повреждение печени, но и оказывает защитное действие на фиброз и цирроз печени, вызванные хроническими заболеваниями печени [10].Его механизм может быть связан с рядом изменений экспрессии генов, включая гены, связанные с Nrf2, MT, и рецептор транскрипционного фактора farne-soid x (FXR) [11, 12]. Олеаноловая кислота может вызывать индукцию Nrf2-зависимого гена, способствуя накоплению Nrf2 в ядре, что помогает защитить печень от гепатотоксичности, вызванной ацетаминофеном [13]. В более поздних исследованиях было показано, что повышенное накопление Nrf2 в ядре олеаноловой кислотой связано с активацией путей Akt и ERK [14].OA также оказывает защитное действие на CCl4-индуцированное повреждение печени у мышей. Jeong предположил, что ОА ингибирует экспрессию цитохрома P4502E1 [15]. Однако Йим и соавт. [16] считали, что гепатопротекторные эффекты достигаются за счет усиления способности печени к регенерации глутатиона. Кроме того, Ю и соавт. [17] разработали и синтезировали два вида пролекарств ОА, которые обладают очевидным защитным действием в отношении CCl4-индуцированного повреждения печени у мышей, и эти пролекарства улучшили безопасность и эффективность исходного препарата.Кроме того, некоторые производные ОА усиливали гепатопротекторные эффекты, такие как наносуспензии [1] и производные олеаноловой кислоты-аминокислоты [18].
В более поздних исследованиях было показано, что повышенное накопление Nrf2 в ядре олеаноловой кислотой связано с активацией путей Akt и ERK [14].OA также оказывает защитное действие на CCl4-индуцированное повреждение печени у мышей. Jeong предположил, что ОА ингибирует экспрессию цитохрома P4502E1 [15]. Однако Йим и соавт. [16] считали, что гепатопротекторные эффекты достигаются за счет усиления способности печени к регенерации глутатиона. Кроме того, Ю и соавт. [17] разработали и синтезировали два вида пролекарств ОА, которые обладают очевидным защитным действием в отношении CCl4-индуцированного повреждения печени у мышей, и эти пролекарства улучшили безопасность и эффективность исходного препарата.Кроме того, некоторые производные ОА усиливали гепатопротекторные эффекты, такие как наносуспензии [1] и производные олеаноловой кислоты-аминокислоты [18].
2.2. Противоопухолевая активность
ОА является одним из наиболее распространенных тритерпеноидов в растениях и обладает противоопухолевой активностью в отношении многих линий рака, таких как рак печени [19], рак щитовидной железы [20], рак легких [21], рак шейки матки [22] и рак желудка [23].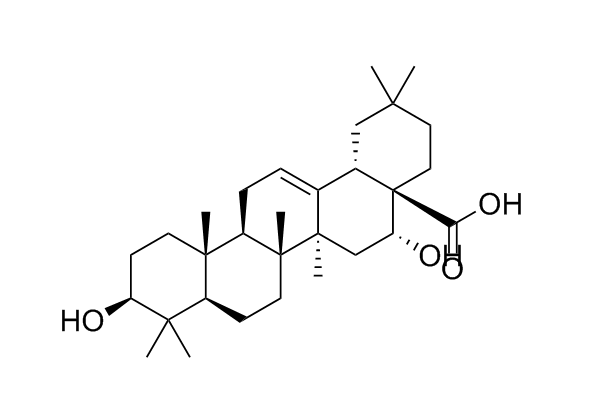 В настоящее время имеется много сообщений о лечении рака печени с помощью ОА.Исследования показали, что ингибирование роста раковых клеток ОА опосредовано подавлением миграции и инвазии раковых клеток, апоптозом митохондрий, остановкой клеточного цикла G2/M и дезактивацией сигнального пути JNK/p38 [24, 25]. Яо и др. [26] доказали, что ОА значительно индуцирует экспрессию UGT1As в HepG2, а индукция UGT1A1 опосредована активацией PXR, а не CAR. Кроме того, исследования показали, что комбинация ОА и ингибиторов аутофагии или ингибирования р-гликопротеина может играть лучшую роль в противораковом эффекте [27, 28].OA имеет большую молекулярную массу и низкую растворимость, что приводит к низкой противоопухолевой эффективности. Поэтому исследователи разработали множество производных ОА, таких как гибрид ОА/гедерагенин-донор оксида азота [29], 2-циано-3, 12-диоксоолеана-1,9(11)-диен-28-овая кислота (CDDO ), и его модифицированное производное С-28: метиловый эфир (CDDO-Me) [30] и комплекс золота (I), содержащий производное ОА [31].
В настоящее время имеется много сообщений о лечении рака печени с помощью ОА.Исследования показали, что ингибирование роста раковых клеток ОА опосредовано подавлением миграции и инвазии раковых клеток, апоптозом митохондрий, остановкой клеточного цикла G2/M и дезактивацией сигнального пути JNK/p38 [24, 25]. Яо и др. [26] доказали, что ОА значительно индуцирует экспрессию UGT1As в HepG2, а индукция UGT1A1 опосредована активацией PXR, а не CAR. Кроме того, исследования показали, что комбинация ОА и ингибиторов аутофагии или ингибирования р-гликопротеина может играть лучшую роль в противораковом эффекте [27, 28].OA имеет большую молекулярную массу и низкую растворимость, что приводит к низкой противоопухолевой эффективности. Поэтому исследователи разработали множество производных ОА, таких как гибрид ОА/гедерагенин-донор оксида азота [29], 2-циано-3, 12-диоксоолеана-1,9(11)-диен-28-овая кислота (CDDO ), и его модифицированное производное С-28: метиловый эфир (CDDO-Me) [30] и комплекс золота (I), содержащий производное ОА [31]. Фан и др. [32] продемонстрировали, что ОА, покрытый нанолипосомами, приводит к усилению противораковых эффектов за счет подавления пролиферации, миграции и инвазии.В недавних противоопухолевых исследованиях комбинированная терапия стала горячей точкой. Некоторые исследователи подготовили гибридные наночастицы (HN) карбоната кальция (CC), украшенные мембранами раковых клеток (CM), для доставки цисплатина (CDDP) и OA. Результаты показали, что по сравнению со свободными лекарствами по отдельности или моносистемами, он может усиливать клеточный апоптоз и может обратить вспять множественную лекарственную устойчивость раковых клеток [33, 34].
Фан и др. [32] продемонстрировали, что ОА, покрытый нанолипосомами, приводит к усилению противораковых эффектов за счет подавления пролиферации, миграции и инвазии.В недавних противоопухолевых исследованиях комбинированная терапия стала горячей точкой. Некоторые исследователи подготовили гибридные наночастицы (HN) карбоната кальция (CC), украшенные мембранами раковых клеток (CM), для доставки цисплатина (CDDP) и OA. Результаты показали, что по сравнению со свободными лекарствами по отдельности или моносистемами, он может усиливать клеточный апоптоз и может обратить вспять множественную лекарственную устойчивость раковых клеток [33, 34].
2.3. Противовоспалительная активность
ОА обладает выраженным противовоспалительным действием и эффективен при различных воспалениях [35], таких как васкулит [36], энтерит [37] и трахеит [38].В частности, ОА оказывает ингибирующее действие на комплемент у крыс и обладает противовоспалительной активностью как при адъювантно-индуцированном артрите, так и при каррагинан-индуцированном отеке лапы у крыс [39]. Ким и др. [40] предположили, что противовоспалительные и противоастматические эффекты ОА могут проявляться за счет ингибирования путей GATA-3 и связанных с ретиноевой кислотой орфанных рецепторов γ t. В более позднем исследовании было обнаружено, что противовоспалительная активность ОА связана с сигнальными путями МАРК [41]. Ван и др.[42] продемонстрировали, что лечение ОА может в зависимости от дозы улучшать повреждение спинного мозга за счет препятствования p38- и JNK-регулируемому апоптозу и воспалению. Таким образом, ОА может служить эффективным терапевтическим средством для лечения травм спинного мозга. Кроме того, биологические тесты in vitro показали, что некоторые производные ОА проявляют значительную противовоспалительную активность, что свидетельствует о положительном эффекте гидроксилирования по С-7 и гликозилирования по С-28 [43].
Ким и др. [40] предположили, что противовоспалительные и противоастматические эффекты ОА могут проявляться за счет ингибирования путей GATA-3 и связанных с ретиноевой кислотой орфанных рецепторов γ t. В более позднем исследовании было обнаружено, что противовоспалительная активность ОА связана с сигнальными путями МАРК [41]. Ван и др.[42] продемонстрировали, что лечение ОА может в зависимости от дозы улучшать повреждение спинного мозга за счет препятствования p38- и JNK-регулируемому апоптозу и воспалению. Таким образом, ОА может служить эффективным терапевтическим средством для лечения травм спинного мозга. Кроме того, биологические тесты in vitro показали, что некоторые производные ОА проявляют значительную противовоспалительную активность, что свидетельствует о положительном эффекте гидроксилирования по С-7 и гликозилирования по С-28 [43].
2.4. Борьба с метаболическим синдромом
Метаболический синдром состоит из аномальных факторов метаболизма, таких как дислипидемия, нарушение толерантности к глюкозе, резистентность к инсулину, воспаление, ожирение и гипертония. Как правило, метаболический синдром ассоциирован со многими патологиями, особенно с сахарным диабетом 2 типа, ожирением и сердечно-сосудистыми заболеваниями [44–47]. ОА обладает потенциальным защитным действием в отношении краткосрочной и долгосрочной метаболической дисфункции, вызванной фруктозой у крыс [48]. И его механизм действия может быть связан с ядерным фактором 1b гепатоцитов, важным регулятором метаболизма глюкозы и липидов [49]. Многие производные ОА обладают терапевтическим действием при метаболических заболеваниях, например патент CN 103739652A ( α -глюкозидаза ингибиторы), CN 102838651A (производные ОА как гипогликемические средства) и CN 1682740A (производные ОА как ингибиторы гликогенфосфорилазы) [50].
Как правило, метаболический синдром ассоциирован со многими патологиями, особенно с сахарным диабетом 2 типа, ожирением и сердечно-сосудистыми заболеваниями [44–47]. ОА обладает потенциальным защитным действием в отношении краткосрочной и долгосрочной метаболической дисфункции, вызванной фруктозой у крыс [48]. И его механизм действия может быть связан с ядерным фактором 1b гепатоцитов, важным регулятором метаболизма глюкозы и липидов [49]. Многие производные ОА обладают терапевтическим действием при метаболических заболеваниях, например патент CN 103739652A ( α -глюкозидаза ингибиторы), CN 102838651A (производные ОА как гипогликемические средства) и CN 1682740A (производные ОА как ингибиторы гликогенфосфорилазы) [50].
Распространенность ожирения тревожно растет, и это стало глобальной проблемой. Сообщалось об эффектах ОА против ожирения у мышей [51–53]. Ким и др. [54] показали, что ОА ингибирует воспалительную реакцию во время дифференцировки адипоцитов посредством блокирования передачи сигналов IL-6-TRAF6-NF- κ B и висфатина, провоспалительного и специфичного для висцерального жира адипокина, экспрессируемого в адипоцитах [55]. ОА может ингибировать выработку жира при сохранении общего уровня эстрогена, что может быть связано со значительным подавлением АСС, ключевого гена синтеза жира [56].Кроме того, ожирение приводит к хроническому воспалению во всем организме, однако SO1989 (производное ОА) может восстанавливать баланс между поляризованными M1 и поляризованными M2 макрофагами у мышей с ожирением, вызванный диетой с высоким содержанием жиров (HFD), тем самым улучшая воспаление жира и метаболические нарушения. дисфункция [57]. Недавнее исследование показало, что введение ОА крысам с предиабетом может улучшить соотношение массы тела и печени и значительно снизить уровень триглицеридов в плазме и липопротеинов очень низкой плотности [58]. DKS26 (производное ОА) играет роль гипогликемического, гиполипидемического и островкового защитного действия через сигнальный путь цАМФ/ПКА [59].Более того, нано-ОА может эффективно улучшать метаболическую дисфункцию, вызванную диетой с высоким содержанием жиров, у крыс путем улучшения его биодоступности и фармакодинамических свойств [60].
ОА может ингибировать выработку жира при сохранении общего уровня эстрогена, что может быть связано со значительным подавлением АСС, ключевого гена синтеза жира [56].Кроме того, ожирение приводит к хроническому воспалению во всем организме, однако SO1989 (производное ОА) может восстанавливать баланс между поляризованными M1 и поляризованными M2 макрофагами у мышей с ожирением, вызванный диетой с высоким содержанием жиров (HFD), тем самым улучшая воспаление жира и метаболические нарушения. дисфункция [57]. Недавнее исследование показало, что введение ОА крысам с предиабетом может улучшить соотношение массы тела и печени и значительно снизить уровень триглицеридов в плазме и липопротеинов очень низкой плотности [58]. DKS26 (производное ОА) играет роль гипогликемического, гиполипидемического и островкового защитного действия через сигнальный путь цАМФ/ПКА [59].Более того, нано-ОА может эффективно улучшать метаболическую дисфункцию, вызванную диетой с высоким содержанием жиров, у крыс путем улучшения его биодоступности и фармакодинамических свойств [60]. Таким образом, ОА и его производные являются потенциальными препаратами против метаболического синдрома.
Таким образом, ОА и его производные являются потенциальными препаратами против метаболического синдрома.
2.5. Другая фармакологическая активность
ОА обладает антиоксидантным действием, и его механизм может быть связан с увеличением образования антиоксиданта и экспрессией чувствительных к окислительному стрессу факторов транскрипции — киназ Nrf2 и MAP [61, 62].Исследования показали, что ОА оказывает нейропротекторное действие, подавляя активированный окислительный стресс и воспалительную реакцию клеток микроглии, связанных с болезнью Альцгеймера [63–65]. Кроме того, ОА также обладает антиостеопорозным, антипролиферативным действием клеток предстательной железы, антимышечным, противогриппозным и антидепрессивным действием [66–70].
3. Новая лекарственная форма олеаноловой кислоты
Фармакокинетические данные различных лекарственных форм олеаноловой кислоты представлены в таблице 1.Как показано в таблице 1, метод, используемый в большинстве экспериментов, представляет собой LC-MC, объектом эксперимента являются крысы SD, и приведены абсолютная биодоступность и относительная биодоступность. Можно видеть, что новые лекарственные формы в различной степени улучшили биодоступность по сравнению с имеющимися в продаже таблетками олеаноловой кислоты. Далее мы проведем конкретный анализ новых лекарственных форм.
Можно видеть, что новые лекарственные формы в различной степени улучшили биодоступность по сравнению с имеющимися в продаже таблетками олеаноловой кислоты. Далее мы проведем конкретный анализ новых лекарственных форм.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.1. Циклодекстрин Включение
Благодаря своей внешней гидрофильной и внутренней гидрофобной структуре циклодекстрин может обертывать многие низкомолекулярные препараты для улучшения растворимости в воде нерастворимых препаратов [78].Фактически разные типы циклодекстринов имеют разную интенсивность повышения растворимости в воде. Ли и др. [79] получили соединение включения олеаноловой кислоты β -циклодекстрин методом насыщенного водного раствора и измерили растворимость лекарственного средства с помощью ВЭЖХ. Результат показал, что растворимость соединений включения в воде увеличилась в 3,4 раза. После добавления NaOH с образованием соли растворимость увеличилась в 107 раз. В то время как добавление поливинилпирролидона не может улучшить растворимость насыщенных соединений, а также повлиять на активность олеаноловой кислоты.Wang [72] использовал гидроксипропил β -циклодекстрин для получения соединения включения олеаноловой кислоты и разработал метод фармакокинетического обнаружения (ВЭЖХ-МС) после перорального введения олеаноловой кислоты. Наконец, была проанализирована абсолютная биодоступность соединения включения кислоты-гидроксипропил β -циклодекстрина у крыс, и результаты показали, что абсолютная биодоступность составила 2,010% по сравнению с соответствующими литературными данными [80]; пероральная биодоступность () была в определенной степени улучшена.Рен и др. [80] использовали синтетические длинноцепочечные производные амино β -циклодекстрина тетраэтиленпентамин- β -циклодекстрина для получения соединений включения олеаноловой кислоты.
После добавления NaOH с образованием соли растворимость увеличилась в 107 раз. В то время как добавление поливинилпирролидона не может улучшить растворимость насыщенных соединений, а также повлиять на активность олеаноловой кислоты.Wang [72] использовал гидроксипропил β -циклодекстрин для получения соединения включения олеаноловой кислоты и разработал метод фармакокинетического обнаружения (ВЭЖХ-МС) после перорального введения олеаноловой кислоты. Наконец, была проанализирована абсолютная биодоступность соединения включения кислоты-гидроксипропил β -циклодекстрина у крыс, и результаты показали, что абсолютная биодоступность составила 2,010% по сравнению с соответствующими литературными данными [80]; пероральная биодоступность () была в определенной степени улучшена.Рен и др. [80] использовали синтетические длинноцепочечные производные амино β -циклодекстрина тетраэтиленпентамин- β -циклодекстрина для получения соединений включения олеаноловой кислоты. Можно сделать вывод, что растворимость олеаноловой кислоты в воде улучшилась в 2100 раз. Опреан и др. [81] выбрали противоопухолевую активность in vitro соединения включения циклодекстрина олеаноловой кислоты в качестве показателя и выбрали 2-гидроксипропил-b-циклодекстрин в качестве наиболее подходящего материала включения. Напротив, сообщается [82], что сила взаимодействия между олеаноловой кислотой и природными производными β -циклодекстрина ( β -ЦД) выше, чем у соответствующих модифицированных гидроксипропилом β -ЦД, а константа комплексообразования γ -CD в 6 раз больше β -CD.Получение олеаноловой кислоты методом включения циклодекстрина действительно может улучшить растворимость, но исследования ее метаболической абсорбции и биодоступности in vivo все еще недостаточны.
Можно сделать вывод, что растворимость олеаноловой кислоты в воде улучшилась в 2100 раз. Опреан и др. [81] выбрали противоопухолевую активность in vitro соединения включения циклодекстрина олеаноловой кислоты в качестве показателя и выбрали 2-гидроксипропил-b-циклодекстрин в качестве наиболее подходящего материала включения. Напротив, сообщается [82], что сила взаимодействия между олеаноловой кислотой и природными производными β -циклодекстрина ( β -ЦД) выше, чем у соответствующих модифицированных гидроксипропилом β -ЦД, а константа комплексообразования γ -CD в 6 раз больше β -CD.Получение олеаноловой кислоты методом включения циклодекстрина действительно может улучшить растворимость, но исследования ее метаболической абсорбции и биодоступности in vivo все еще недостаточны.
3.2. Твердая дисперсия
Процесс приготовления твердой дисперсии (ТД) относительно прост, что является одним из средств улучшения растворения и биодоступности лекарств. Обычно используемые носители для твердых дисперсий включают повидон (pvp) [83], сшитый повидон (pvpp) [73] и нанокарбонат кальция [84].Некоторые исследователи выбрали композитный носитель PVPk30-Soluplus для приготовления твердой дисперсии олеаноловой кислоты, что, очевидно, может увеличить растворение и скорость растворения этого компонента и улучшить эффект его растворения [85]. Гао и др. [83] разработали аморфные твердые дисперсии ОА (ОА-ПВП) методом экструзии горячего расплава, в которых не использовались органические растворители, поэтому они были безопасными и экологичными [86]. Оценка in vitro и in vivo показала значительное улучшение OA-PVP по сравнению с коммерческими таблетками.В частности, фармакокинетический анализ на крысах показал, что биодоступность OA-PVP примерно в 2,4 раза выше, чем у таблеток OA. Например, Wang et al. [73] разработали олеаноловую кислоту-поливинилполипирролидон (ОА-ПВПП-СД) с помощью простого метода испарения растворителя. Тест на растворение показал, что примерно 50-75% ОА растворялось из ТД в течение первых 10 минут, что примерно в 10-15 раз больше свободного ОА.
Обычно используемые носители для твердых дисперсий включают повидон (pvp) [83], сшитый повидон (pvpp) [73] и нанокарбонат кальция [84].Некоторые исследователи выбрали композитный носитель PVPk30-Soluplus для приготовления твердой дисперсии олеаноловой кислоты, что, очевидно, может увеличить растворение и скорость растворения этого компонента и улучшить эффект его растворения [85]. Гао и др. [83] разработали аморфные твердые дисперсии ОА (ОА-ПВП) методом экструзии горячего расплава, в которых не использовались органические растворители, поэтому они были безопасными и экологичными [86]. Оценка in vitro и in vivo показала значительное улучшение OA-PVP по сравнению с коммерческими таблетками.В частности, фармакокинетический анализ на крысах показал, что биодоступность OA-PVP примерно в 2,4 раза выше, чем у таблеток OA. Например, Wang et al. [73] разработали олеаноловую кислоту-поливинилполипирролидон (ОА-ПВПП-СД) с помощью простого метода испарения растворителя. Тест на растворение показал, что примерно 50-75% ОА растворялось из ТД в течение первых 10 минут, что примерно в 10-15 раз больше свободного ОА. Фармакокинетические исследования in vivo показали, что OA-PVPP-SD имеет более короткую () и повышенную () по сравнению с прямым пероральным введением OA, а его относительная биодоступность составляет 183.07%. Таким образом, OA-SD, изготовленный из композитного носителя, может значительно улучшить скорость растворения OA in vitro, но биодоступность требует дальнейшего изучения.
Фармакокинетические исследования in vivo показали, что OA-PVPP-SD имеет более короткую () и повышенную () по сравнению с прямым пероральным введением OA, а его относительная биодоступность составляет 183.07%. Таким образом, OA-SD, изготовленный из композитного носителя, может значительно улучшить скорость растворения OA in vitro, но биодоступность требует дальнейшего изучения.
3.3. Нанометровый препарат
Нанометровые препараты стали центром исследований в последние годы, и нанотехнология обладает уникальными преимуществами в улучшении растворимости, медленном и контролируемом высвобождении и нацеливании на плохо растворимые лекарства [87]. В последние годы многие исследователи применили нанотехнологии для получения олеаноловой кислоты.Далее будут подробно рассмотрены различные нанопрепараты.
3.3.1. Самомикроэмульгирующая система доставки лекарств
Yang et al. [88–90] провели более всестороннее исследование самомикроэмульгирующейся системы доставки лекарств олеаноловой кислоты (SMEDDS-OA). Результаты теста растворения SMEDDS-OA in vitro показали, что кумулятивная скорость растворения препарата за 15 минут достигала более 85%, в то время как у эталонных таблеток, продаваемых на рынке, менее 60%, а растворимость увеличилась более чем в 1000 раз по сравнению с ОА [88].В ходе фармакокинетических исследований in vivo на крысах SMEDDS-OA проявляется раньше и выше, чем у эталонной таблетки, а его относительная биодоступность достигла 507,03% [89]. Се и др. [74] также изучали фармакокинетику SMEDDS-OA на крысах. И аналогично по сравнению с пероральными таблетками его относительная биодоступность достигла 402,24%. Это предполагает, что самомикроэмульгирующаяся система доставки лекарств может улучшить растворимость и биодоступность ОА. Одним словом, основные экспериментальные исследования более полны, а отчетов о клинических испытаниях немного.
Результаты теста растворения SMEDDS-OA in vitro показали, что кумулятивная скорость растворения препарата за 15 минут достигала более 85%, в то время как у эталонных таблеток, продаваемых на рынке, менее 60%, а растворимость увеличилась более чем в 1000 раз по сравнению с ОА [88].В ходе фармакокинетических исследований in vivo на крысах SMEDDS-OA проявляется раньше и выше, чем у эталонной таблетки, а его относительная биодоступность достигла 507,03% [89]. Се и др. [74] также изучали фармакокинетику SMEDDS-OA на крысах. И аналогично по сравнению с пероральными таблетками его относительная биодоступность достигла 402,24%. Это предполагает, что самомикроэмульгирующаяся система доставки лекарств может улучшить растворимость и биодоступность ОА. Одним словом, основные экспериментальные исследования более полны, а отчетов о клинических испытаниях немного.
3.3.2. Наночастицы
Приготовив наночастицы ОА, ОА может достичь цели медленного высвобождения и нацеливания, чтобы лучше проявить противоопухолевый эффект [91, 92], повысить безопасность лекарств и расширить область применения лекарств [75, 93]. Ся и др. [93] разработали новую систему нанодоставки лактоферрина, нагруженную наночастицами OA (OA-NP). Эксперимент по растворению in vitro показал, что через 20 минут скорость растворения ОА-НПС составила 80%, а контрольного ОА — только 40%. Фармакокинетическое исследование на крысах показало, что его относительная биодоступность составляет 320.5%. Ван и др. [94] инкапсулировали OA в наночастицы с помощью амфифильной карбоксилированной целлюлозы-прививки-поли (CC-g-PLLA, рис. 2), что может улучшить растворимость в воде и время высвобождения препарата и показать сильную противоопухолевую активность. Хан и др. [95] разработали рН-зависимую систему нанодоставки карбоната кальция для комбинации химиотерапевтических препаратов цисплатина и ОА при лечении гепатоцеллюлярной карциномы. Исследования показали, что он может уменьшить токсичность печени, вызванную химиотерапевтическими препаратами, и преодолеть лекарственную устойчивость.Более того, некоторые исследователи [96, 97] приготовили наночастицы с ОА, нагруженными TPGS-PLGA и mPEG-PLGA соответственно, которые могут улучшить антибактериальную и противоопухолевую активность.
Ся и др. [93] разработали новую систему нанодоставки лактоферрина, нагруженную наночастицами OA (OA-NP). Эксперимент по растворению in vitro показал, что через 20 минут скорость растворения ОА-НПС составила 80%, а контрольного ОА — только 40%. Фармакокинетическое исследование на крысах показало, что его относительная биодоступность составляет 320.5%. Ван и др. [94] инкапсулировали OA в наночастицы с помощью амфифильной карбоксилированной целлюлозы-прививки-поли (CC-g-PLLA, рис. 2), что может улучшить растворимость в воде и время высвобождения препарата и показать сильную противоопухолевую активность. Хан и др. [95] разработали рН-зависимую систему нанодоставки карбоната кальция для комбинации химиотерапевтических препаратов цисплатина и ОА при лечении гепатоцеллюлярной карциномы. Исследования показали, что он может уменьшить токсичность печени, вызванную химиотерапевтическими препаратами, и преодолеть лекарственную устойчивость.Более того, некоторые исследователи [96, 97] приготовили наночастицы с ОА, нагруженными TPGS-PLGA и mPEG-PLGA соответственно, которые могут улучшить антибактериальную и противоопухолевую активность. Исследования in vitro показали, что наночастицы PLGA, стабилизированные TPGS и содержащие OA, были более чувствительны к патогенным бактериям. Например, TPGS-PLGA-OA в 25 раз более селективен, чем чистый OA в случае штамма дикого типа. Точно так же mPEG-PLGA-OA проявляет более сильную цитотоксичность по отношению к раковым клеткам и более эффективен для доставки ОА.
Исследования in vitro показали, что наночастицы PLGA, стабилизированные TPGS и содержащие OA, были более чувствительны к патогенным бактериям. Например, TPGS-PLGA-OA в 25 раз более селективен, чем чистый OA в случае штамма дикого типа. Точно так же mPEG-PLGA-OA проявляет более сильную цитотоксичность по отношению к раковым клеткам и более эффективен для доставки ОА.
3.3.3. Нанолипосома
Липосомы привлекли внимание людей из-за своей структуры, сходной со структурой биопленки, сильной загрузки лекарствами и способности к транспортировке. Преобразование олеаноловой кислоты в нанолипосомы имеет медленное и контролируемое высвобождение, нацеливание, снижение токсических и побочных эффектов и усиление противоопухолевого действия [98]. Кроме того, приготовление нанолипосом адриамицина и ОА может снижать кардиотоксичность адриамицина, но не влияет на противоопухолевую активность [99].Лю и др. [76] получили гидрофильные липосомы ОА, модифицированные поливинилпирролидоном К30 (ПВП-К30). Результаты характеристических исследований показали, что средний размер частиц составляет 179,4 нм, эффективность инкапсуляции превышает 90%, а биодоступность при пероральном приеме достигает 607,9%. Ли и др. [100] разработали и подготовили новые модифицированные октреотидом магнитные липосомы (OMlips) для магнитно-ориентирующей и опосредованной рецепторами доставки противоопухолевых препаратов с двойной направленностью. Используя OA в качестве лекарственного средства, был приготовлен OA-OMLips.В исследовании высвобождения лекарственного средства in vitro около 23% OA высвобождается из OA-OMLips в течение 12 часов, что задерживает высвобождение лекарственного средства. Исследования противоопухолевого эффекта in vivo показали, что объем опухоли OA-OMLips с магнитной группой на 53% меньше, чем у OA-OMLips без магнитной группы, что свидетельствует о том, что система доставки лекарств эффективно увеличивает накопление лекарств в опухолевых тканях и улучшает противоопухолевый эффект. . Таким образом, противоопухолевая активность ОА делает его часто используемым в качестве адъюванта для разработки комбинированной терапии рака.
Результаты характеристических исследований показали, что средний размер частиц составляет 179,4 нм, эффективность инкапсуляции превышает 90%, а биодоступность при пероральном приеме достигает 607,9%. Ли и др. [100] разработали и подготовили новые модифицированные октреотидом магнитные липосомы (OMlips) для магнитно-ориентирующей и опосредованной рецепторами доставки противоопухолевых препаратов с двойной направленностью. Используя OA в качестве лекарственного средства, был приготовлен OA-OMLips.В исследовании высвобождения лекарственного средства in vitro около 23% OA высвобождается из OA-OMLips в течение 12 часов, что задерживает высвобождение лекарственного средства. Исследования противоопухолевого эффекта in vivo показали, что объем опухоли OA-OMLips с магнитной группой на 53% меньше, чем у OA-OMLips без магнитной группы, что свидетельствует о том, что система доставки лекарств эффективно увеличивает накопление лекарств в опухолевых тканях и улучшает противоопухолевый эффект. . Таким образом, противоопухолевая активность ОА делает его часто используемым в качестве адъюванта для разработки комбинированной терапии рака.
3.3.4. Мицеллы
Мицеллы могут улучшить растворимость, растворение и биодоступность ОА. Обычно используемые методы подготовки включают диализ, выпаривание растворителя и диспергирование пленки [101]. Например, Хао [5] приготовил смешанные мицеллы, нагруженные OA, используя метод гидратации тонкой пленки этанола, охарактеризовал мицеллы OA и изучил высвобождение in vitro и эффективность лекарственного средства in vivo. Результаты показали, что средний размер частиц мицелл ОА в водной фазе составляет нм, DL составляет 3.5%, а ЕЕ составляет . Исследования высвобождения лекарственного средства in vitro показали, что около 80% ОА высвобождается из диализного мешка, содержащего свободный ОА, через 24 часа, в то время как мицеллы ОА составляют только 40%, что позволяет достичь цели замедленного высвобождения. Кроме того, мицеллы OA проявляли более высокую противоопухолевую эффективность, чем свободный OA, как в клетках A549, так и в клетках PC-9. Результаты показали, что мицеллы ОА могут значительно уменьшить размер опухоли, ингибировать инвазию, миграцию и эпителиально-мезенхимальный переход in vivo. В заключение, полимерные мицеллы являются многообещающей системой доставки нанолекарств при раке легкого.
В заключение, полимерные мицеллы являются многообещающей системой доставки нанолекарств при раке легкого.
3.3.5. Эмульсия нанометров
Некоторые исследователи [102] получали наноэмульсии, содержащие ОА, со средним размером частиц менее 60 нм. Испытания на стабильность показали, что наноэмульсии ОА обладают хорошими физическими свойствами (малый размер капель, низкая вязкость), стабильны в течение не менее 1 месяца, без нестабильности. Результаты экспериментов in vivo показали, что препарат нетоксичен и не раздражает кожу, а наноэмульсия обладает высокой способностью проникать в кожу, что может усиливать противовоспалительный эффект ОА.Наноэмульсия, изготовленная из OA, может играть лучшую противовоспалительную роль после чрескожного всасывания.
3.3.6. Фосфолипидный комплекс
Jan et al. [77] получили отвержденный фосфолипидный комплекс (OPCH), состоящий из OA-фосфолипидного комплекса (OPC) и гидроксиапатита (HA), используя простой метод испарения растворителя. Исследования показали, что растворимость OPCH в воде в 15,3 раза выше, чем у OA, а кумулятивная скорость растворения OPCH in vitro в 2,23 раза выше, чем у OA через 2 часа.Кроме того, комбинация OPCH и кетоконазола может ингибировать метаболизм OA в кишечном тракте и повышать биодоступность OPCH, которая в 2,72 раза выше, чем у OA. В заключение, OPCH предназначен для улучшения всасывания OA в кишечнике, а его растворимость в воде и биодоступность OA улучшаются в разной степени.
Исследования показали, что растворимость OPCH в воде в 15,3 раза выше, чем у OA, а кумулятивная скорость растворения OPCH in vitro в 2,23 раза выше, чем у OA через 2 часа.Кроме того, комбинация OPCH и кетоконазола может ингибировать метаболизм OA в кишечном тракте и повышать биодоступность OPCH, которая в 2,72 раза выше, чем у OA. В заключение, OPCH предназначен для улучшения всасывания OA в кишечнике, а его растворимость в воде и биодоступность OA улучшаются в разной степени.
3.3.7. Мультивезикулярные липосомы
Некоторые исследователи [103, 104] методом двойной эмульсии получали мультивезикулярные липосомы, инкапсулированные ОА (ОА-МВЛ), и охарактеризовали их.Результаты показали, что средний размер частиц OA-MVL составлял 11,57 мкм мкм, эффективность инкапсуляции абсолютного дзета-потенциала составляла -13,35 мВ, а индекс полидисперсности составлял 0,21. Исследования in vitro показали, что OA-MVL могут лучше поглощаться HepG2 и усиливать эффект ингибирования роста клеток HepG2. Дальнейшие эксперименты in vivo на мышах с опухолью h32 показали, что OA-MVL обладают лучшим противоопухолевым действием, чем раствор OA. В частности, ОАМВЛ оказывали значительное ингибирующее действие на выживаемость раковых клеток печени при 160 мкМ моль/л, но не оказывали существенного влияния на жизнеспособность нормальных клеток печени, что доказывает безопасность препарата для клинического применения.
Дальнейшие эксперименты in vivo на мышах с опухолью h32 показали, что OA-MVL обладают лучшим противоопухолевым действием, чем раствор OA. В частности, ОАМВЛ оказывали значительное ингибирующее действие на выживаемость раковых клеток печени при 160 мкМ моль/л, но не оказывали существенного влияния на жизнеспособность нормальных клеток печени, что доказывает безопасность препарата для клинического применения.
4. Производные олеаноловой кислоты
Основными участками структурной модификации олеаноловой кислоты являются кольцо А, кольцо С-28 и кольцо С. Производные, модифицированные в разных положениях, обладают разной фармакологической активностью, и их соотношение структура-активность показано в таблице 2. Путь синтеза основных производных показан на рисунке 3. от модификации
Реагент и условия следующие: (a) K2CO3, ДМФА, замещенный бензилбромид или галогеналкан, кт; б – 1 – NaH, ДМФА, Ch4I, rt; (2) 5% NaOH, ДМФ, кт; (3) ангидриды кислот, ДМАП, ТГФ или кислоты, ДМАП, ЭДХИ, ДХМ; в – янтарный ангидрид, ДМАП, Ch3Cl2, ком. т., 24 ч, 87–97%; (г) ClCh3COCh4, ДМФА, K2CO3, 60°C; (д) Ch3Cl2, рт; (е) (1) NaBh5, Ch4OH, 0°C; (2) Boc-аминокислота, DCC, DMAP, Ch3Cl2, rt; (ж) (1) p-Ch4C6h5SO3H, Ch4OH, rt; (2) (C2H5)2O, сухой газ HCl, 0°C, затем водный раствор NaHCO3; з – раствор хромовой кислоты, ацетон, 0°С, 1 ч [114]; и – 1 – SiO2, реактив Джонса, ацетон, 30 мин, 0°С, 98%; (2) трибромид пиридиния, AcOH, 2 ч, 25°C, кв. (3) NaOH, ДМФА, инертный газ, 0°С, численно; (4) NaBh5, MeOH, ТГФ, 0°C, 1 ч, 48% и 45% [115]; (к) Ас2О, ТЭА, ДМАП, ДХМ, 25°С, 20 ч, 76-78%; (л) (1) Дифенилфосфорилазид, ТЭА, толуол, 180°С, 3 ч, микроволны, 76%; (2) HClq, ТГФ, 30–50°С, 2–24 ч, 76%; (3) фенилизоцианат, толуол, 2 ч, 25°С, 69%; (м) ДМФ, K2CO3, комнатная темп.; (m) EDCI, DMAP, дефлегмация, комнатная температура; (n) (1) Ac2O, NEt3, DMAP, DCM, 88%; (2) оксалилхлорид, ТГФ, ДХМ, пиперазин 49%; (0) оксалилхлорид, ТГФ; NEt3, ДМАП, 25°C, 2 ч, 50%.
т., 24 ч, 87–97%; (г) ClCh3COCh4, ДМФА, K2CO3, 60°C; (д) Ch3Cl2, рт; (е) (1) NaBh5, Ch4OH, 0°C; (2) Boc-аминокислота, DCC, DMAP, Ch3Cl2, rt; (ж) (1) p-Ch4C6h5SO3H, Ch4OH, rt; (2) (C2H5)2O, сухой газ HCl, 0°C, затем водный раствор NaHCO3; з – раствор хромовой кислоты, ацетон, 0°С, 1 ч [114]; и – 1 – SiO2, реактив Джонса, ацетон, 30 мин, 0°С, 98%; (2) трибромид пиридиния, AcOH, 2 ч, 25°C, кв. (3) NaOH, ДМФА, инертный газ, 0°С, численно; (4) NaBh5, MeOH, ТГФ, 0°C, 1 ч, 48% и 45% [115]; (к) Ас2О, ТЭА, ДМАП, ДХМ, 25°С, 20 ч, 76-78%; (л) (1) Дифенилфосфорилазид, ТЭА, толуол, 180°С, 3 ч, микроволны, 76%; (2) HClq, ТГФ, 30–50°С, 2–24 ч, 76%; (3) фенилизоцианат, толуол, 2 ч, 25°С, 69%; (м) ДМФ, K2CO3, комнатная темп.; (m) EDCI, DMAP, дефлегмация, комнатная температура; (n) (1) Ac2O, NEt3, DMAP, DCM, 88%; (2) оксалилхлорид, ТГФ, ДХМ, пиперазин 49%; (0) оксалилхлорид, ТГФ; NEt3, ДМАП, 25°C, 2 ч, 50%.
4.1. Структурная модификация кольца
Liang et al. [105] разработали и синтезировали ряд производных 1 α , 2 α -эпокси-3 β -гидроксиолеаноловой кислоты. Была изучена антибактериальная активность in vitro, и результаты показали, что 1a (рис. 4) обладает хорошей антибактериальной активностью в отношении Escherichia coli и Bacillus subtilis, а степень ингибирования in vitro может достигать 60% и 80% соответственно, что эквивалентно стрептомицину. 2а и 3а обладали лучшей ингибирующей активностью в отношении Klebsiella pneumonia, подобно клиндамицину.4а обладал лучшей ингибирующей активностью в отношении роста бауманновских бацилл. Исследования антибактериальной активности in vitro показали, что введение орто-цианозамещенной бензильной группы и короткоцепочечного алкилового эфира в 28-карбоксильную группу может улучшить антибактериальную активность 1 α , 2 α -эпокси-3 β -гидроксиолеаноловая кислота. А введение ацетильной группы в 3-гидроксильную группу может повысить ингибирующую активность производных ОА в отношении бактерий. Как описано, эти недавно разработанные производные ОА обладают уникальной антибактериальной активностью и в будущем могут стать потенциальными антибактериальными препаратами.
Была изучена антибактериальная активность in vitro, и результаты показали, что 1a (рис. 4) обладает хорошей антибактериальной активностью в отношении Escherichia coli и Bacillus subtilis, а степень ингибирования in vitro может достигать 60% и 80% соответственно, что эквивалентно стрептомицину. 2а и 3а обладали лучшей ингибирующей активностью в отношении Klebsiella pneumonia, подобно клиндамицину.4а обладал лучшей ингибирующей активностью в отношении роста бауманновских бацилл. Исследования антибактериальной активности in vitro показали, что введение орто-цианозамещенной бензильной группы и короткоцепочечного алкилового эфира в 28-карбоксильную группу может улучшить антибактериальную активность 1 α , 2 α -эпокси-3 β -гидроксиолеаноловая кислота. А введение ацетильной группы в 3-гидроксильную группу может повысить ингибирующую активность производных ОА в отношении бактерий. Как описано, эти недавно разработанные производные ОА обладают уникальной антибактериальной активностью и в будущем могут стать потенциальными антибактериальными препаратами.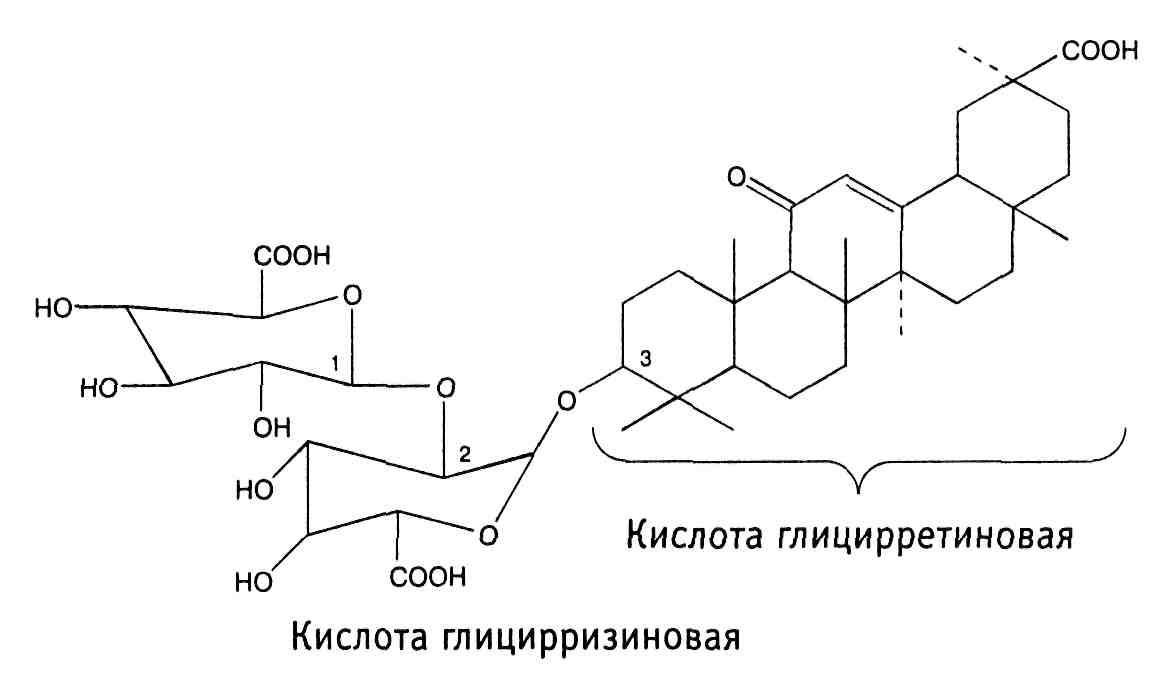
Кроме того, есть сообщение [106], что для производных олеаноловой кислоты роль свободной карбоновой кислоты делает ее более эффективной противопаразитарной активностью. Цзоу и др. [107] проанализировали зависимость структура-активность (SAR) ряда полусинтетических производных ОА. Результаты показали, что ингибирование карбоксиэстеразы 1 человека (hCE1) 28-карбоксильной группой OA очень важно, а модификации OA в этом сайте, включая сложные эфиры, амиды и спирты, неблагоприятны для ингибирования hCE1.Напротив, модификации гидроксильной группы C-3 полезны для ингибирования hCE1. Замена гидроксильной группы C-3 кетонами или сложными эфирами может усилить эффект ингибирования hCE1 и иметь высокую селективность по отношению к hCE2. Среди них гидроксильная группа C-3 превращается в 3-O- β -карбоксипропионильную группу, значительно усиливается ингибирующее действие соединения 5a на hCE1, а селективность к hCE2 также очень высока, что может быть использовано в качестве лекарство-кандидат для разработки и дизайна hCE1. Из приведенного выше видно, что сохранение карбоксильной группы C-28 полезно для проявления определенных биологических активностей олеаноловой кислоты.
Из приведенного выше видно, что сохранение карбоксильной группы C-28 полезно для проявления определенных биологических активностей олеаноловой кислоты.
4.2. Структурная модификация C-28
Cao et al. [116] разработали и синтезировали семь связанных с пропиленгликолем пролекарств диэфира аминокислоты ОА, которые были предназначены для нацеливания на транспортер пептида 1 (PepT1). Растворимость в воде соединения 1-6b (рис. 5) составляет 35,3, 23,4, 12,3, 69,6, 58,2 и 83,2 мк г/мл соответственно, что значительно выше, чем у ОА с плохой растворимостью в воде.Для скрининга эффективной проницаемости и сродства пролекарства к PepT1 использовали модель однопроходной кишечной перфузии крысы in situ и модель клеток Caco-2. Результаты показали, что соединения 1b и 5b превосходили другие соединения. Фармакокинетические эксперименты проводили после перорального введения 1b и 5b. Результаты продемонстрировали, что по сравнению с группой ОА, и увеличилась в 3,04 раза () и 3,55 раза () в группе 1b и увеличилась в 2,62 раза () и 3,39 раза () в группе 5b, что увеличило пероральную биодоступность ОА. .В заключение, дизайн пролекарств олеаноловой кислоты, нацеленных на переносчик пептида 1, является эффективным способом преодоления плохой растворимости OA и низкой пероральной доступности.
.В заключение, дизайн пролекарств олеаноловой кислоты, нацеленных на переносчик пептида 1, является эффективным способом преодоления плохой растворимости OA и низкой пероральной доступности.
Группа Джи связала аспирин с карбоксильной группой в положении 28, чтобы получить ряд конъюгатов 7-9b [108]. Исследовали ингибирующую активность конъюгата олеаноловой кислоты и аспирина в отношении синтеза 5-гидрокситриптамина и активность, способствующую формированию костей. Среди них конъюгат 7b оказывал наиболее сильное ингибирующее действие на серотонин со степенью ингибирования до 87.2%, что немного выше, чем у положительного контроля LP533401, который в 12 раз больше, чем олеаноловая кислота, и в 14 раз больше, чем аспирин. В эксперименте по стимулированию активности остеобластов конъюгат 7b также показал самую сильную активность, которая была близка к пролиферативному эффекту препарата положительного контроля. Сравнивая конъюгаты 8b и 9b с 7b, можно сделать вывод, что карбонильная группа в положении 28 ОА является фармакофором для синтеза антисеротонина, а модификация гидроксила в положении 3 мало влияет на активность.
4.3. Структурная модификация кольца С
Производное ОА 1С (рис. 6) обладает гепатопротекторным действием и превосходит ламивудин в подавлении восстановления скорости репликации вируса. Некоторые исследователи изучили защитный эффект 1С на повреждение печени, вызванное четыреххлористым углеродом (CCl4) у крыс, и всесторонне оценили защитный эффект 1С на печень с помощью гистологического анализа, иммуногистохимического окрашивания и тестов на острую токсичность [117]. Гистологический анализ показал, что группа, принимавшая высокие дозы 1C, продемонстрировала явное облегчение в аномальных областях, а клетки печени вернулись в здоровое состояние.Тем не менее, группа с низкими дозами также имела умеренную степень облегчения. Более того, 1С может ингибировать экспрессию цитокина TGF- β 1, тесно связанного с фиброзом клеток печени, и оказывать свое антифиброзное действие. А испытание на острую токсичность показало, что 1С малотоксичен. Исследования фармакокинетики однократной пероральной дозы 1C показали, что она составляет мкг г/мл, мкг г ч/мл и составляет ч, что исключает период полувыведения дольше, чем ОА, что позволяет предположить, что 1С является потенциальным лекарством против фиброза печени.
4.4. Структурная модификация кольца А и положения С-28
4.4.1. Кольцевая модификация и амидирование C-28
Sommerwerk et al. [109] синтезировали маслиновую кислоту с олеаноловой кислотой, модифицированной кольцом A, а также амидированной C-28, чтобы синтезировать ряд производных OA для изучения их токсичности и селективности в отношении опухолевых клеток человека. Результаты показали, что EC 50 соединения 1d (фиг. 7) для клеток рака яичников A2780 составляла 0,9 мкМ , а для фибробластов >120 мкМ , эффект был наилучшим.Это указывает на то, что введение ацетильных групп в положения С-2 и С-3 и наличие центров (2 β , 3 β )-конфигурации, а также фрагмента фенилмочевины в положении С-28 очень важны. необходимо для получения высокой цитотоксичности и сохранения селективности между злокачественными клетками и фибробластами мыши.
Сонг и др. [118] разработали и синтезировали ряд производных олеаноловой кислоты и оценили их как ингибиторы проникновения вируса птичьего гриппа H5N1. Исследования взаимосвязи структура-активность (SAR) показали, что тонкая модификация OA в качестве агликона оказывает важное влияние на противовирусную активность. Будь то введение дизамещенной амидной структуры в С-28 OA или изменение конфигурации C-3 OA с 3 β на 3 α , индекс селективности OA может быть значительно улучшен при сохранении его противовирусной активности in vitro. Среди этих производных соединение 2d (рис. 8) продемонстрировало превосходную активность против H5N1 в эксперименте с ингибирующей активностью, с меньшей, чем у положительного контроля CL-385319 (), что может быть использовано в качестве образца для дальнейшей разработки соединения ингибитора проникновения H5N1 или строительные леса.Более того, ингибирующая активность соединений 3d, 4d и 5d (рис. 8) в отношении H5N1 аналогична, что указывает на то, что разнообразие пентациклического тритерпенового структурного каркаса не оказывает существенного влияния на его анти-H5N1-активность.
Исследования взаимосвязи структура-активность (SAR) показали, что тонкая модификация OA в качестве агликона оказывает важное влияние на противовирусную активность. Будь то введение дизамещенной амидной структуры в С-28 OA или изменение конфигурации C-3 OA с 3 β на 3 α , индекс селективности OA может быть значительно улучшен при сохранении его противовирусной активности in vitro. Среди этих производных соединение 2d (рис. 8) продемонстрировало превосходную активность против H5N1 в эксперименте с ингибирующей активностью, с меньшей, чем у положительного контроля CL-385319 (), что может быть использовано в качестве образца для дальнейшей разработки соединения ингибитора проникновения H5N1 или строительные леса.Более того, ингибирующая активность соединений 3d, 4d и 5d (рис. 8) в отношении H5N1 аналогична, что указывает на то, что разнообразие пентациклического тритерпенового структурного каркаса не оказывает существенного влияния на его анти-H5N1-активность.
Ю и др. [110] использовали олеаноловую кислоту 3-O- β -D-глюкуронопиранозид (OAGP) в качестве исходного материала после амидирования в положении C-28 и модификации сахарной группы, получив в результате соединение 6d (рис. 9). Предварительная обработка клеток H9c2 соединением 6d показала лучший защитный эффект, чем OAGP.Выживаемость увеличилась с 49,69% (при лечении только H 2 O 2 ) до 58,69%, но эффект не такой хороший, как у производных скелета урсоловой кислоты. Таким образом, экспериментальные результаты показали, что амидирование С-28 и соединение изобутила благоприятно для защиты кардиомиоцитов.
[110] использовали олеаноловую кислоту 3-O- β -D-глюкуронопиранозид (OAGP) в качестве исходного материала после амидирования в положении C-28 и модификации сахарной группы, получив в результате соединение 6d (рис. 9). Предварительная обработка клеток H9c2 соединением 6d показала лучший защитный эффект, чем OAGP.Выживаемость увеличилась с 49,69% (при лечении только H 2 O 2 ) до 58,69%, но эффект не такой хороший, как у производных скелета урсоловой кислоты. Таким образом, экспериментальные результаты показали, что амидирование С-28 и соединение изобутила благоприятно для защиты кардиомиоцитов.
4.4.2. Модификация кольца А и этерификация C-28
Hu et al. [111] использовали олеаноловую кислоту в качестве лидера, ввели структуру эфира оксима в положение C-3, ввели метильную группу и бензильную группу и заместили ароматический углеводород в карбоксильную позицию C-28, чтобы получить соединение 1-3e (рис. 10).Все соединения 1-3е проявляли определенную ингибирующую активность в отношении глюкозамин-6-фосфатсинтазы (GlmS), но эффект был сравним с ОА. Кроме того, соединения 1д и 2д показали лучшую бактерицидную активность в отношении Sclerotinia sclerotiorum, Botrytis cinerea томата и рисовой пирикуляриоза, которая была значительно лучше, чем ОА, но ниже, чем у препаратов положительного контроля. Из этого отчета видно, что OA вводит структуру эфира оксима, а этерификация в положении C-28 не приводит к значительному улучшению анти-Glms-активности.
Кроме того, соединения 1д и 2д показали лучшую бактерицидную активность в отношении Sclerotinia sclerotiorum, Botrytis cinerea томата и рисовой пирикуляриоза, которая была значительно лучше, чем ОА, но ниже, чем у препаратов положительного контроля. Из этого отчета видно, что OA вводит структуру эфира оксима, а этерификация в положении C-28 не приводит к значительному улучшению анти-Glms-активности.
В последние годы модификация кольца A OA и этерификация положения C-28 для соединения различных фармакофоров с целью изучения их противоопухолевой активности стали актуальными [119, 120]. Ван и др. [112] разработали и синтезировали ряд производных OA-циннамата с использованием подхода молекулярной гибридизации. А метод МТТ использовали для определения цитотоксичности рака шейки матки HeLa, рака молочной железы MCF-7 и нормальных клеток печени L-O2 in vitro. Результаты показали, что 4e (фиг. 11) обладал самым сильным селективным эффектом уничтожения в отношении клеток HeLa, а 5e (фиг. 10) в отношении MCF-7 обладал самым сильным селективным эффектом уничтожения.Кроме того, соединение 6e (фиг. 10) также проявляло сильную селективную ингибирующую активность в отношении клеток HeLa. Из приведенных выше результатов мы знаем, что введение бензильной группы с заместителем в положении С-28 может усилить его противораковую активность. 4-метилкоричная кислота, связанная с кольцом А, может значительно усиливать ингибирующее действие ОА на клетки MCF-7.
10) в отношении MCF-7 обладал самым сильным селективным эффектом уничтожения.Кроме того, соединение 6e (фиг. 10) также проявляло сильную селективную ингибирующую активность в отношении клеток HeLa. Из приведенных выше результатов мы знаем, что введение бензильной группы с заместителем в положении С-28 может усилить его противораковую активность. 4-метилкоричная кислота, связанная с кольцом А, может значительно усиливать ингибирующее действие ОА на клетки MCF-7.
Денг и др. [121] использовали агликон олеаноловой кислоты в качестве исходного материала для этерификации положения С-28 и введения сахарной группы в положение С-3 для получения производного OA 7e (рис. 12).Клетки рака толстой кишки человека (HCT8) были отобраны для эксперимента по противоопухолевой активности in vitro, в котором степень ингибирования производного гликозида ОА 7e достигала 98,26% при концентрации как адриамицин в других концентрациях. Хотя противоопухолевый эффект производного 7e не идеален, он улучшает растворимость производных в воде, что позволяет предположить, что гликозильную модификацию можно использовать для улучшения растворимости в воде нерастворимых соединений.
4.4.3. Модификация кольца и положение C-28 соединяет азотсодержащий гетероцикл
Чтобы улучшить противоопухолевую активность олеаноловой кислоты, некоторые исследователи провели несколько полезных исследований. Фридрих [122] ацетилировал положение С-3, а азотсодержащий гетероцикл в положении С-28 присоединял к каркасу катионной функциональной группой с получением соединения 1f (рис. 13). А 1f обладал хорошей цитотоксичностью по отношению к клеткам рака молочной железы человека MCF-7.Его цитотоксичность в 17 раз больше, чем у стандартного вещества бетулиновой кислоты, и в 50 раз больше, чем у ОА, что, по-видимому, доказывает, что тип тритерпеновой кислоты, тип амидной связи, тип катионного остатка и характер его замещения имеют важное значение для опухолевая цитотоксичность. Gao [113] обсудил потенциальную противоопухолевую активность производного 2f олеаноловой кислоты (рис. 13). Используя анализ жизнеспособности клеток для расчета IC 50 для шести типов опухолей, было обнаружено, что 2f обладает широким противоопухолевым действием, а его IC 50 на клетки остеосаркомы значительно ниже, чем на другие опухолевые клетки, что указывает на то, что он имеет тенденцию ингибировать рост клетки остеосаркомы. Противоопухолевые эксперименты in vivo на голых мышах показали, что 2f может уменьшать объем и вес опухоли и обладает низкой токсичностью. Учитывая приведенные выше результаты, его молекулярный механизм связан со снижением экспрессии ферментов, связанных с гликолизом, у голых мышей.
Противоопухолевые эксперименты in vivo на голых мышах показали, что 2f может уменьшать объем и вес опухоли и обладает низкой токсичностью. Учитывая приведенные выше результаты, его молекулярный механизм связан со снижением экспрессии ферментов, связанных с гликолизом, у голых мышей.
5. Заключение
В заключение, приготовление новых лекарственных форм и модификация химической структуры ОА могут улучшить биодоступность и расширить область применения, что является двумя эффективными способами разработки и разработки новых лекарств.Несмотря на то, что методы достигли большого прогресса, все еще есть некоторые проблемы, которые требуют дальнейшего изучения и исследования. Например, мало инновационных исследований, модифицированная лекарственная форма не подвергалась биологическим испытаниям, а активность полученного производного снижена или не имеет значительного улучшения. В будущих исследованиях мы должны прояснить цель эксперимента, изучить опыт предшественников и изучить необходимые функциональные группы, фармакофор и ненужные заместители, чтобы провести точную и разумную модификацию. Более того, с ростом лекарственной устойчивости некоторых бактерий и вирусов разработка новых лекарств из натуральных продуктов стала повальным увлечением исследователей, а пентациклические тритерпены привлекли большое внимание из-за их различной фармакологической активности. Примечательно, что широко распространенная в природе олеаноловая кислота обладает выраженной биологической активностью и большим исследовательским потенциалом. Требуется больше исследователей, чтобы как можно скорее разработать продукты на благо человечества.
Более того, с ростом лекарственной устойчивости некоторых бактерий и вирусов разработка новых лекарств из натуральных продуктов стала повальным увлечением исследователей, а пентациклические тритерпены привлекли большое внимание из-за их различной фармакологической активности. Примечательно, что широко распространенная в природе олеаноловая кислота обладает выраженной биологической активностью и большим исследовательским потенциалом. Требуется больше исследователей, чтобы как можно скорее разработать продукты на благо человечества.
Доступность данных
Данные, использованные для поддержки результатов этого исследования, можно получить у соответствующего автора по запросу.
Конфликт интересов
У авторов нет конфликта интересов, о котором следует заявить.
Вклад авторов
А.Ф. написал первоначальный проект; С.Ю., Л.З., Ф.Б. и А.Ф. рассмотрели и отредактировали рукопись; Л.Л. осуществляла супервизию; LL приобрела фонд. Все авторы прочитали и согласились с опубликованной версией рукописи.
Благодарности
Эта работа была поддержана Национальным крупным проектом по науке и технологиям (создание крупных новых лекарств) (2017ZX09301064).
Основные источники олеаноловой кислоты.
Цели. Цель этого исследования заключалась в изучении биологических функций сигнальных путей mTOR и AMPK при раке толстой кишки (CC). Также были исследованы потенциальные молекулярные механизмы, с помощью которых олеаноловая кислота (ОА) вызывает аутофагию и апоптоз. Методы. Биологические функции mTOR были проанализированы с помощью GeneCards, Инструмента поиска для поиска взаимодействующих генов (STRING) и Базы данных для аннотации, визуализации и комплексного обнаружения (DAVID).Регрессионный анализ оператора наименьшей абсолютной усадки и отбора (LASSO) был использован для получения прогностических данных и данных о выживаемости пациентов с СС из базы данных Gene Expression Omnibus (GEO). Влияние ОА на клеточные линии CC HCT-116 и SW-480 анализировали с помощью CCK-8, анализа образования колоний и сканирования массива системы с высоким содержанием (HCS). Скорость апоптоза клеток SW-480 и HCT-116 определяли с помощью проточной цитометрии. Уровни экспрессии мРНК и белка в клетках HCT-116 и SW-480 и нормальных эпителиальных клетках толстой кишки NCM-460 определяли с помощью RT-PCR и Вестерн-блоттинга.Результаты. mTOR был высоко экспрессирован у больных РШМ и действовал как онкоген. Сигнальный путь AMPK, опосредованный mTOR, предсказывал неблагоприятный прогноз у пациентов с РШМ. ОА эффективно ингибировал пролиферацию и жизнеспособность клеток СС. Кроме того, скорость апоптоза клеток СС явно увеличивалась после введения ОА. Что касается молекулярного механизма ОА, результаты показали, что ОА подавляет mTOR и ген антиапоптоза Bcl-2. Кроме того, гены-регуляторы аутофагии и апоптоза, включая ВАХ, каспазу-9, каспазу-8 и каспазу-3, значительно усиливались при ОА.Более того, ОА активировал AMPK и нижележащие белки, включая TSC2, BAX, Beclin 1, LC3B-II и ULK1, вызывая аутофагию и апоптоз в клетках CC. Вывод. Результаты этого исследования демонстрируют, что ОА может эффективно ингибировать пролиферацию и жизнеспособность клеток СС.
Скорость апоптоза клеток SW-480 и HCT-116 определяли с помощью проточной цитометрии. Уровни экспрессии мРНК и белка в клетках HCT-116 и SW-480 и нормальных эпителиальных клетках толстой кишки NCM-460 определяли с помощью RT-PCR и Вестерн-блоттинга.Результаты. mTOR был высоко экспрессирован у больных РШМ и действовал как онкоген. Сигнальный путь AMPK, опосредованный mTOR, предсказывал неблагоприятный прогноз у пациентов с РШМ. ОА эффективно ингибировал пролиферацию и жизнеспособность клеток СС. Кроме того, скорость апоптоза клеток СС явно увеличивалась после введения ОА. Что касается молекулярного механизма ОА, результаты показали, что ОА подавляет mTOR и ген антиапоптоза Bcl-2. Кроме того, гены-регуляторы аутофагии и апоптоза, включая ВАХ, каспазу-9, каспазу-8 и каспазу-3, значительно усиливались при ОА.Более того, ОА активировал AMPK и нижележащие белки, включая TSC2, BAX, Beclin 1, LC3B-II и ULK1, вызывая аутофагию и апоптоз в клетках CC. Вывод. Результаты этого исследования демонстрируют, что ОА может эффективно ингибировать пролиферацию и жизнеспособность клеток СС. Анти-СС активность ОА тесно связана с активацией сигнального пути AMPK-mTOR. Активация AMPK и ингибирование mTOR участвуют в индукции аутофагии и апоптоза при ОА. ОА индуцировал аутофагию и апоптоз в основном в зависимости от активации AMPK в клетках CC.1. Введение
Рак толстой кишки (КР) является одной из самых распространенных злокачественных опухолей и третьим по распространенности раком после рака легкого и предстательной железы в мире [1]. Согласно глобальным онкологическим данным, насчитывается около 1,1 млн впервые диагностированных больных РШМ и 550 тыс. летальных исходов, связанных с РШМ, и прогнозируется увеличение уровня смертности от РХ на 60% в 2035 г. [2, 3]. Как правило, хирургия, лучевая терапия и химиотерапия в настоящее время являются основными вариантами лечения пациентов с РШМ. Однако только 70% РШМ являются резектабельными, из них 75% излечимы, а у 25% резецированных пациентов будут рецидивы опухоли [4].Даже при прогрессе в ранней диагностике и лечении 5-летняя относительная выживаемость больных РШМ составляет всего 63% [1]. Более того, растущая лекарственная устойчивость и побочные эффекты, связанные с лучевой терапией и химиотерапией, серьезно ухудшают качество жизни пациентов с РШМ. Таким образом, срочно необходимы новые стратегии лечения и препараты для удовлетворения клинических потребностей пациентов с РШМ.
Аутофагия представляет собой консервативную систему самодеградации, которая имеет решающее значение для поддержания клеточного гомеостаза в условиях стресса.Нарушение регуляции аутофагии имеет значение для здоровья и рака. В частности, при раке аутофагия играет дихотомическую роль, подавляя инициацию опухоли, но поддерживая ее прогрессирование [5]. Подобно апоптозу, аутофагия является формой гибели клеток [6]. Аутофагия в основном регулируется сигнальным путем AMPK/mTOR, сигнальным путем PI3K/Akt/mTOR и другими родственными сигнальными путями аутофагии. Как один из классических сигнальных путей в регуляции аутофагии, сигнальный путь AMPK/mTOR обеспечивает множество потенциальных терапевтических мишеней для CC.mTOR, атипичная серин/треониновая протеинкиназа, регулирует рост и пролиферацию клеток, преимущественно стимулируя ключевые анаболические процессы, определяя уровни питания и факторы роста, а также различные сигналы окружающей среды [7, 8]. Более того, mTOR был определен как онкоген при РШМ и стал эффективной мишенью для терапии РХ как в исследованиях in vitro, так и в доклинических исследованиях [9, 10]. Кроме того, активируемая аденозинмонофосфатом (AMP) протеинкиназа (AMPK) играет ключевую роль в поддержании энергетического гомеостаза, обнаруживая потерю энергии и активируя клеточную аутофагию [11].Активация AMPK может индуцировать уровни экспрессии каспазы-3, каспазы-8 и каспазы-9, что приводит к апоптозу в клетках СС [12]. Активация AMPK также стимулировала аутофагию за счет увеличения уровня экспрессии белка Beclin 1 и LC3-II и снижения уровня p-mTOR и p-ULK1 в клетках CC [13]. Более того, AMPK может негативно регулировать мишень mTOR у млекопитающих, тем самым индуцируя аутофагию и апоптоз CC in vivo и in vitro [13, 14]. Конститутивно подавление mTOR, а также комплекса mTOR 1 (mTORC1) было продемонстрировано в клетках СС, усиливая способность модулировать ингибирование роста, пролиферацию, апоптоз и аутофагию СС [14].Следовательно, регуляция сигнального пути AMPK/mTOR может в значительной степени способствовать лечению РШМ.
Олеаноловая кислота (3-α-3-гидроксиолеан-12-ен-28-овая кислота, ОА) представляет собой природную пентациклическую тритерпеновую карбоновую кислоту, широко распространенную в растительных молекулах. Исследована противораковая активность ОА при различных типах опухолей, таких как колоректальный рак, рак щитовидной железы, рак желудка, рак молочной железы и рак предстательной железы [15, 16]. В исследованиях рака толстой кишки предыдущее исследование показало, что ОА снижает способность к пролиферации клеток HCT-15, останавливая клеточный цикл в фазе G0/G1 и ингибируя репликацию ДНК [17].Другое исследование показало, что ОА вызывает сильную остановку клеточного цикла G0/G1 и фрагментацию ДНК в клетках HT-29 и Caco-2. Кроме того, ОА приводил к митохондриальному апоптозу, зависящему от повышения активности каспазы-3 через р53-независимый механизм [18]. Кроме того, ингибирование пролиферации клеток НТ-29, вызванное ОА, происходило дозозависимым образом [19]. Другое исследование показало, что ОА и его аналоги с индуцирующей апоптоз активностью эффективно ингибировали частоту аномальных углублений и множественных поражений у крыс с раком толстой кишки, указывая на то, что ОА и его аналоги оказывают химиопрофилактическое действие на рак толстой кишки in vivo [20].В то же время многочисленные клинические испытания фазы I показали, что ОА и его производные проявляют мощную противоопухолевую активность при прогрессирующих солидных опухолях с ограниченной токсичностью [21, 22]. Таким образом, очевидно, что ОА является перспективным терапевтическим агентом против СС.
В этом исследовании мы предварительно исследовали биологические функции сигнальных путей mTOR и AMPK при РШМ. Кроме того, были исследованы терапевтические эффекты и потенциальные молекулярные механизмы ОА в клетках СС. Результаты этого исследования показали, что mTOR был высоко экспрессирован у пациентов с РШМ и действовал как онкоген.Сигнальный путь AMPK, опосредованный mTOR, предсказывал неблагоприятный прогноз у пациентов с РШМ. Кроме того, ОА ингибировал пролиферацию и жизнеспособность клеток СС. Скорость апоптоза клеток CC была явно увеличена после лечения ОА. Кроме того, активация AMPK и ингибирование mTOR участвуют в аутофагии и апоптозе, индуцированных ОА. Противораковая активность ОА тесно связана с активацией сигнального пути AMPK-mTOR, который имеет решающее значение в процессах апоптоза и аутофагии.ОА индуцировал апоптоз и аутофагию преимущественно через механизм, зависимый от активации AMPK, в клетках CC. 2. Материалы и методы 2.1. Биоинформатика mTOR
Для изучения взаимодействующих генов, белков и сигнальных путей mTOR был применен ключевой сенсор аутофагии и апоптоза — база данных GeneCards (https://www.genecards.org/) [23]. Сеть белок-белкового взаимодействия (PPI) mTOR была построена с помощью Search Tool for the Retrieval of Interacting Genes (STRING, http://string-db.org, версия 11.0) [24]. Для дальнейшего исследования молекулярных механизмов mTOR при CC использовалась база данных для аннотации, визуализации и интегрированного обнаружения (DAVID, http://david.ncifcrf.gov, версия 6.8) [25]. Биологическая информация была извлечена из всеобъемлющего набора генов и белков, что обеспечивает функциональные аннотации. Анализ обогащения Киотской энциклопедии генов и генома (KEGG) был применен для анализа функции и путей клеточной передачи сигналов mTOR. Пузырьковые графики результатов обогащения были построены с использованием пакета «ggplot» в программном обеспечении R (версия 3.6.3, 64-разрядная версия, https://www.r-project.org/). считалось статистически значимым.
База данных Gene Expression Omnibus (GEO, http://www.ncbi.nlm.nih.gov/geo) была применена для получения прогностических данных и сопоставимых данных о выживаемости пациентов с РШМ. Регрессионный анализ оператора наименьшей абсолютной усадки и отбора (LASSO) [26] был выполнен для прогностической ценности генов-мишеней с помощью R-пакета glmnet. 2.2. Приготовление олеаноловой кислоты и реагентов
Стандарт OA (чистота ≥ 98%, кат. № CHB180311) был приобретен у Chroma Biotechnology Co, Ltd.(Чэнду, Китай). ОА растворяли в диметилсульфоксиде (ДМСО) и разбавляли до соответствующей концентрации при нанесении на клеточные линии.
Акадезин (AICAR, кат. № HY-13417), специфический агонист AMPK, и рапамицин (кат. № AY-22989), селективный низкомолекулярный ингибитор mTOR, были получены от MedChem Express (Шанхай, Китай). . AICAR и рапамицин растворяли в ДМСО и разбавляли до указанных концентраций при нанесении на клеточные линии. 2.3. Клеточные линии и культура
Клеточные линии COAD человеческого происхождения SW-480 (ATA-CL1052) и HCT-116 (CL0125) были приобретены в PuJian Cell Center (Ухань, Китай) и FengHui Cell Center (Пекин, Китай) соответственно, а нормальная толстая кишка человека эпителиальную клеточную линию NCM-460 (ATA-CL1041) приобретали в PuJian Cell Center (Ухань, Китай).Все клеточные линии культивировали в среде Игла, модифицированной Дульбекко (Gibco, Thermo Fisher Scientific, Inc.), включающей 10% эмбриональную бычью сыворотку (Gibco, Thermo Fisher Scientific, Inc.), 1% стрептомицин и пенициллин (Thermo Fisher Scientific, Inc. ), а затем выращивали в 5% CO2 при 37°C. 2.4. Жизнеспособность клеток и оценка пролиферации
Жизнеспособность клеток SW-480 и HCT-116, обработанных ОА в течение 24 ч, оценивали путем добавления 10% (об./об.) набора для подсчета клеток-8 (CCK-8; лот. PG658, Доджиндо, Токио, Япония) к клеток и инкубируют 15 мин при 37°С.Поглощение измеряли при 450 нм. Жизнеспособность клеток рассчитывали как жизнеспособность клеток (%) = 100 × (обработка OD/контроль OD). Для клеток SW-480 и HCT-116 рассчитывали 50% ингибирующую концентрацию (IC50).
Пролиферацию клеток HCT-116 и SW-480 оценивали с помощью анализа образования колоний. Пятьсот раковых клеток на лунку высевали в двенадцатилуночный планшет. Затем клетки культивировали на свежей среде, содержащей ОА или ДМСО. Среду заменяли каждые 2 дня. Через десять дней колонии фиксировали 4% параформальдегидом в течение 10 мин, а затем 0.Окрашивание 25% кристаллическим фиолетовым при комнатной температуре. 2.5. Флуоресцентное окрашивание и морфологическая идентификация
Образцы клеток собирали и окрашивали флуоресцентными красителями. Основные флуоресцентные красители включали Hoechst 33342 (h4570, Invitrogen) для количественного подсчета клеток, кальцеин AM (C3099, Invitrogen) для отслеживания выживаемости клеток, гомодимер-1 этидия (EthD-1) (L3224, Invitrogen) для отслеживания апоптотических клеток, Deep Red Actin Tracking Stain (A57245, Invitrogen) для маркировки нитевидного актина (F-актин, клеточная структура мембран) и тетраметилродамин (TMRM, T668, Invitrogen) в качестве индикатора потенциала митохондриальной мембраны.Морфологическую идентификацию и количественную статистику клеток HCT-116 и SW-480 исследовали с помощью сканирования матрицы системы высокого содержания (HCS) (Thermo Scientific, Массачусетс, США). О параметрах и настройках формы сообщалось ранее O’Brien et al. [27] и Ян и соавт. [23], а длина волны в разных каналах устанавливалась для сбора флуоресцентных изображений. Среднюю интенсивность флуоресценции клеток анализировали с помощью системы Array Scan XTI с помощью программного алгоритма. 2.6. Проточная цитометрия (FCM) для анализа апоптоза
Апоптоз клеток HCT-116 и SW-480 анализировали с помощью FCM.Набор для обнаружения апоптоза (каталожный номер 559763) был приобретен у BD (Сан-Хосе, Калифорния). Клетки для эксперимента собирали и промывали холодным PBS, а затем окрашивали аннексином V/PE и 7-аминоактиномицином (7-AAD) в 400 мкл буфера для связывания. Клетки инкубировали в течение 20 мин при комнатной температуре и анализировали скорость апоптоза с помощью FCM (BD, FACSCanto II, США). 2.7. Количественная ПЦР в реальном времени для экспрессии мРНК
Анализ микрочипов выполняли с использованием экстрактов РНК из клеток SW-480, HCT-116 и NCM-460 для проверки уровня экспрессии мРНК.Наносили реагент TRIzol (Nordic Bioscience, Пекин, Китай) и превращали мРНК в кДНК с помощью набора для обратной транскрипции (Thermo Scientific, США) согласно протоколу производителя. Последовательности праймеров для mTOR, Bcl-2, BAX, каспазы-3, каспазы-8 и каспазы-9 перечислены в таблице 1. Количественную ПЦР в реальном времени для этих мРНК проводили и анализировали с использованием кДНК и SYBR Green PCR Master Mix. (Nordic Bioscience, Пекин, Китай). ОТ-ПЦР проводили на системе 7500 Fast Real-Time PCR (Applied Biosystems, Фостер-Сити, Калифорния, США).Относительные количества мРНК определяли на основе расчетов 2-ΔΔCt с β-актином в качестве эндогенного эталона. Гены
Вперед
Обеспечить регресс мТОР
CTTGCTGAACTGGAGGCTGATGG
CCGTTTTCTTATGGGCTGGCTCTC
Бкл-2
TACGAGTGGGATGCGGGAGATG
CCGGGCTGGGAGGAGAAGATG
БАКС
GATGCGTCCCACAAGAAGCTGAG
CACGGCGGCAATCATCCTCTG
Каспаза-3
GTGGAGGCCGACTTCTTGTATGC
TGGCACAAAGCGACTGGATGAAC
Каспаза-8
CGGATGAGGCTGACTTTCTGCTG
GGCTCTGGCAAAGTGACTGGATG
Каспаза-9
GACCAGAGATTCCGCAAACCAGAGG
AAGAGCACCGACATCACCAAATCC
β-актин
GGCCAACCGCGAGAAGATGAC
GGATAGCACAGCCTGGATAGCAAC
Анти-СС активность ОА тесно связана с активацией сигнального пути AMPK-mTOR. Активация AMPK и ингибирование mTOR участвуют в индукции аутофагии и апоптоза при ОА. ОА индуцировал аутофагию и апоптоз в основном в зависимости от активации AMPK в клетках CC.1. Введение
Рак толстой кишки (КР) является одной из самых распространенных злокачественных опухолей и третьим по распространенности раком после рака легкого и предстательной железы в мире [1]. Согласно глобальным онкологическим данным, насчитывается около 1,1 млн впервые диагностированных больных РШМ и 550 тыс. летальных исходов, связанных с РШМ, и прогнозируется увеличение уровня смертности от РХ на 60% в 2035 г. [2, 3]. Как правило, хирургия, лучевая терапия и химиотерапия в настоящее время являются основными вариантами лечения пациентов с РШМ. Однако только 70% РШМ являются резектабельными, из них 75% излечимы, а у 25% резецированных пациентов будут рецидивы опухоли [4].Даже при прогрессе в ранней диагностике и лечении 5-летняя относительная выживаемость больных РШМ составляет всего 63% [1]. Более того, растущая лекарственная устойчивость и побочные эффекты, связанные с лучевой терапией и химиотерапией, серьезно ухудшают качество жизни пациентов с РШМ. Таким образом, срочно необходимы новые стратегии лечения и препараты для удовлетворения клинических потребностей пациентов с РШМ.
Аутофагия представляет собой консервативную систему самодеградации, которая имеет решающее значение для поддержания клеточного гомеостаза в условиях стресса.Нарушение регуляции аутофагии имеет значение для здоровья и рака. В частности, при раке аутофагия играет дихотомическую роль, подавляя инициацию опухоли, но поддерживая ее прогрессирование [5]. Подобно апоптозу, аутофагия является формой гибели клеток [6]. Аутофагия в основном регулируется сигнальным путем AMPK/mTOR, сигнальным путем PI3K/Akt/mTOR и другими родственными сигнальными путями аутофагии. Как один из классических сигнальных путей в регуляции аутофагии, сигнальный путь AMPK/mTOR обеспечивает множество потенциальных терапевтических мишеней для CC.mTOR, атипичная серин/треониновая протеинкиназа, регулирует рост и пролиферацию клеток, преимущественно стимулируя ключевые анаболические процессы, определяя уровни питания и факторы роста, а также различные сигналы окружающей среды [7, 8]. Более того, mTOR был определен как онкоген при РШМ и стал эффективной мишенью для терапии РХ как в исследованиях in vitro, так и в доклинических исследованиях [9, 10]. Кроме того, активируемая аденозинмонофосфатом (AMP) протеинкиназа (AMPK) играет ключевую роль в поддержании энергетического гомеостаза, обнаруживая потерю энергии и активируя клеточную аутофагию [11].Активация AMPK может индуцировать уровни экспрессии каспазы-3, каспазы-8 и каспазы-9, что приводит к апоптозу в клетках СС [12]. Активация AMPK также стимулировала аутофагию за счет увеличения уровня экспрессии белка Beclin 1 и LC3-II и снижения уровня p-mTOR и p-ULK1 в клетках CC [13]. Более того, AMPK может негативно регулировать мишень mTOR у млекопитающих, тем самым индуцируя аутофагию и апоптоз CC in vivo и in vitro [13, 14]. Конститутивно подавление mTOR, а также комплекса mTOR 1 (mTORC1) было продемонстрировано в клетках СС, усиливая способность модулировать ингибирование роста, пролиферацию, апоптоз и аутофагию СС [14].Следовательно, регуляция сигнального пути AMPK/mTOR может в значительной степени способствовать лечению РШМ.
Олеаноловая кислота (3-α-3-гидроксиолеан-12-ен-28-овая кислота, ОА) представляет собой природную пентациклическую тритерпеновую карбоновую кислоту, широко распространенную в растительных молекулах. Исследована противораковая активность ОА при различных типах опухолей, таких как колоректальный рак, рак щитовидной железы, рак желудка, рак молочной железы и рак предстательной железы [15, 16]. В исследованиях рака толстой кишки предыдущее исследование показало, что ОА снижает способность к пролиферации клеток HCT-15, останавливая клеточный цикл в фазе G0/G1 и ингибируя репликацию ДНК [17].Другое исследование показало, что ОА вызывает сильную остановку клеточного цикла G0/G1 и фрагментацию ДНК в клетках HT-29 и Caco-2. Кроме того, ОА приводил к митохондриальному апоптозу, зависящему от повышения активности каспазы-3 через р53-независимый механизм [18]. Кроме того, ингибирование пролиферации клеток НТ-29, вызванное ОА, происходило дозозависимым образом [19]. Другое исследование показало, что ОА и его аналоги с индуцирующей апоптоз активностью эффективно ингибировали частоту аномальных углублений и множественных поражений у крыс с раком толстой кишки, указывая на то, что ОА и его аналоги оказывают химиопрофилактическое действие на рак толстой кишки in vivo [20].В то же время многочисленные клинические испытания фазы I показали, что ОА и его производные проявляют мощную противоопухолевую активность при прогрессирующих солидных опухолях с ограниченной токсичностью [21, 22]. Таким образом, очевидно, что ОА является перспективным терапевтическим агентом против СС.
В этом исследовании мы предварительно исследовали биологические функции сигнальных путей mTOR и AMPK при РШМ. Кроме того, были исследованы терапевтические эффекты и потенциальные молекулярные механизмы ОА в клетках СС. Результаты этого исследования показали, что mTOR был высоко экспрессирован у пациентов с РШМ и действовал как онкоген.Сигнальный путь AMPK, опосредованный mTOR, предсказывал неблагоприятный прогноз у пациентов с РШМ. Кроме того, ОА ингибировал пролиферацию и жизнеспособность клеток СС. Скорость апоптоза клеток CC была явно увеличена после лечения ОА. Кроме того, активация AMPK и ингибирование mTOR участвуют в аутофагии и апоптозе, индуцированных ОА. Противораковая активность ОА тесно связана с активацией сигнального пути AMPK-mTOR, который имеет решающее значение в процессах апоптоза и аутофагии.ОА индуцировал апоптоз и аутофагию преимущественно через механизм, зависимый от активации AMPK, в клетках CC. 2. Материалы и методы 2.1. Биоинформатика mTOR
Для изучения взаимодействующих генов, белков и сигнальных путей mTOR был применен ключевой сенсор аутофагии и апоптоза — база данных GeneCards (https://www.genecards.org/) [23]. Сеть белок-белкового взаимодействия (PPI) mTOR была построена с помощью Search Tool for the Retrieval of Interacting Genes (STRING, http://string-db.org, версия 11.0) [24]. Для дальнейшего исследования молекулярных механизмов mTOR при CC использовалась база данных для аннотации, визуализации и интегрированного обнаружения (DAVID, http://david.ncifcrf.gov, версия 6.8) [25]. Биологическая информация была извлечена из всеобъемлющего набора генов и белков, что обеспечивает функциональные аннотации. Анализ обогащения Киотской энциклопедии генов и генома (KEGG) был применен для анализа функции и путей клеточной передачи сигналов mTOR. Пузырьковые графики результатов обогащения были построены с использованием пакета «ggplot» в программном обеспечении R (версия 3.6.3, 64-разрядная версия, https://www.r-project.org/). считалось статистически значимым.
База данных Gene Expression Omnibus (GEO, http://www.ncbi.nlm.nih.gov/geo) была применена для получения прогностических данных и сопоставимых данных о выживаемости пациентов с РШМ. Регрессионный анализ оператора наименьшей абсолютной усадки и отбора (LASSO) [26] был выполнен для прогностической ценности генов-мишеней с помощью R-пакета glmnet. 2.2. Приготовление олеаноловой кислоты и реагентов
Стандарт OA (чистота ≥ 98%, кат. № CHB180311) был приобретен у Chroma Biotechnology Co, Ltd.(Чэнду, Китай). ОА растворяли в диметилсульфоксиде (ДМСО) и разбавляли до соответствующей концентрации при нанесении на клеточные линии.
Акадезин (AICAR, кат. № HY-13417), специфический агонист AMPK, и рапамицин (кат. № AY-22989), селективный низкомолекулярный ингибитор mTOR, были получены от MedChem Express (Шанхай, Китай). . AICAR и рапамицин растворяли в ДМСО и разбавляли до указанных концентраций при нанесении на клеточные линии. 2.3. Клеточные линии и культура
Клеточные линии COAD человеческого происхождения SW-480 (ATA-CL1052) и HCT-116 (CL0125) были приобретены в PuJian Cell Center (Ухань, Китай) и FengHui Cell Center (Пекин, Китай) соответственно, а нормальная толстая кишка человека эпителиальную клеточную линию NCM-460 (ATA-CL1041) приобретали в PuJian Cell Center (Ухань, Китай).Все клеточные линии культивировали в среде Игла, модифицированной Дульбекко (Gibco, Thermo Fisher Scientific, Inc.), включающей 10% эмбриональную бычью сыворотку (Gibco, Thermo Fisher Scientific, Inc.), 1% стрептомицин и пенициллин (Thermo Fisher Scientific, Inc. ), а затем выращивали в 5% CO2 при 37°C. 2.4. Жизнеспособность клеток и оценка пролиферации
Жизнеспособность клеток SW-480 и HCT-116, обработанных ОА в течение 24 ч, оценивали путем добавления 10% (об./об.) набора для подсчета клеток-8 (CCK-8; лот. PG658, Доджиндо, Токио, Япония) к клеток и инкубируют 15 мин при 37°С.Поглощение измеряли при 450 нм. Жизнеспособность клеток рассчитывали как жизнеспособность клеток (%) = 100 × (обработка OD/контроль OD). Для клеток SW-480 и HCT-116 рассчитывали 50% ингибирующую концентрацию (IC50).
Пролиферацию клеток HCT-116 и SW-480 оценивали с помощью анализа образования колоний. Пятьсот раковых клеток на лунку высевали в двенадцатилуночный планшет. Затем клетки культивировали на свежей среде, содержащей ОА или ДМСО. Среду заменяли каждые 2 дня. Через десять дней колонии фиксировали 4% параформальдегидом в течение 10 мин, а затем 0.Окрашивание 25% кристаллическим фиолетовым при комнатной температуре. 2.5. Флуоресцентное окрашивание и морфологическая идентификация
Образцы клеток собирали и окрашивали флуоресцентными красителями. Основные флуоресцентные красители включали Hoechst 33342 (h4570, Invitrogen) для количественного подсчета клеток, кальцеин AM (C3099, Invitrogen) для отслеживания выживаемости клеток, гомодимер-1 этидия (EthD-1) (L3224, Invitrogen) для отслеживания апоптотических клеток, Deep Red Actin Tracking Stain (A57245, Invitrogen) для маркировки нитевидного актина (F-актин, клеточная структура мембран) и тетраметилродамин (TMRM, T668, Invitrogen) в качестве индикатора потенциала митохондриальной мембраны.Морфологическую идентификацию и количественную статистику клеток HCT-116 и SW-480 исследовали с помощью сканирования матрицы системы высокого содержания (HCS) (Thermo Scientific, Массачусетс, США). О параметрах и настройках формы сообщалось ранее O’Brien et al. [27] и Ян и соавт. [23], а длина волны в разных каналах устанавливалась для сбора флуоресцентных изображений. Среднюю интенсивность флуоресценции клеток анализировали с помощью системы Array Scan XTI с помощью программного алгоритма. 2.6. Проточная цитометрия (FCM) для анализа апоптоза
Апоптоз клеток HCT-116 и SW-480 анализировали с помощью FCM.Набор для обнаружения апоптоза (каталожный номер 559763) был приобретен у BD (Сан-Хосе, Калифорния). Клетки для эксперимента собирали и промывали холодным PBS, а затем окрашивали аннексином V/PE и 7-аминоактиномицином (7-AAD) в 400 мкл буфера для связывания. Клетки инкубировали в течение 20 мин при комнатной температуре и анализировали скорость апоптоза с помощью FCM (BD, FACSCanto II, США). 2.7. Количественная ПЦР в реальном времени для экспрессии мРНК
Анализ микрочипов выполняли с использованием экстрактов РНК из клеток SW-480, HCT-116 и NCM-460 для проверки уровня экспрессии мРНК.Наносили реагент TRIzol (Nordic Bioscience, Пекин, Китай) и превращали мРНК в кДНК с помощью набора для обратной транскрипции (Thermo Scientific, США) согласно протоколу производителя. Последовательности праймеров для mTOR, Bcl-2, BAX, каспазы-3, каспазы-8 и каспазы-9 перечислены в таблице 1. Количественную ПЦР в реальном времени для этих мРНК проводили и анализировали с использованием кДНК и SYBR Green PCR Master Mix. (Nordic Bioscience, Пекин, Китай). ОТ-ПЦР проводили на системе 7500 Fast Real-Time PCR (Applied Biosystems, Фостер-Сити, Калифорния, США).Относительные количества мРНК определяли на основе расчетов 2-ΔΔCt с β-актином в качестве эндогенного эталона. Гены
Вперед
Обеспечить регресс мТОР
CTTGCTGAACTGGAGGCTGATGG
CCGTTTTCTTATGGGCTGGCTCTC
Бкл-2
TACGAGTGGGATGCGGGAGATG
CCGGGCTGGGAGGAGAAGATG
БАКС
GATGCGTCCCACAAGAAGCTGAG
CACGGCGGCAATCATCCTCTG
Каспаза-3
GTGGAGGCCGACTTCTTGTATGC
TGGCACAAAGCGACTGGATGAAC
Каспаза-8
CGGATGAGGCTGACTTTCTGCTG
GGCTCTGGCAAAGTGACTGGATG
Каспаза-9
GACCAGAGATTCCGCAAACCAGAGG
AAGAGCACCGACATCACCAAATCC
β-актин
GGCCAACCGCGAGAAGATGAC
GGATAGCACAGCCTGGATAGCAAC
Олеаноловая кислота повышает остеогенный потенциал мезенхимальных стромальных клеток путем ингибирования передачи сигналов Notch
Культура клеток и обработка
МСК человека были приобретены у Lonza.Олеаноловую кислоту получали от Sigma-Aldrich (Aldrich-5504). Готовили 100 мМ раствор ОА в диметилсульфоксиде (ДМСО), а все испытуемые концентрации готовили путем разбавления исходного раствора в среде для культивирования клеток. Рекомбинантный BMP2 человека был приобретен в R&D. Клетки культивировали в среде DMEM с добавлением 10% эмбриональной бычьей сыворотки (Gibco BRL, Rockville, MD). После размножения клетки подвергали воздействию среды, содержащей OA и/или BMP2, в течение определенных дней. Поскольку период полураспада ОА составляет от восьми до 16 часов 22 , мы решили менять среду один раз в день в течение семи дней, чтобы вызвать дифференцировку МСК.В конце клетки собирали в разные моменты времени для анализа, как описано ниже.
Анализ люциферазы
МСК с 80% слиянием трансфицировали чувствительными к Notch RBPJ-Luc и SV40-Renilla-Luc (Promega) в присутствии липофектамина 2000 (Invitrogen) с последующей обработкой ОА. Через 24 часа после трансфекции и обработки лизаты анализировали с помощью набора для анализа двойной люциферазы (Promega).
Анализ жизнеспособности клеток
Жизнеспособность МСК измеряли с использованием МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромид) на основе набора для токсикологического анализа in vitro (Sigma, St.Луис, Миссури, США). Вкратце, клетки высевали в 96-луночные планшеты. После роста до 50–60% слияния клетки подвергали воздействию различных концентраций ОА в течение 12 часов, затем супернатант удаляли и клетки обрабатывали окрашивающим раствором МТТ с концентрацией 0,5 мг/мл еще четыре часа. После инкубации супернатант удаляли и добавляли 50 мкл солюбилизирующего буфера из набора Sigma с 0,5% ДМСО. ДМСО добавляли для обеспечения полной растворимости кристаллов формазана. Планшеты встряхивали в течение двух минут и регистрировали оптическую плотность при 590 нм на автоматическом считывающем устройстве для микротитровальных планшетов.Процент жизнеспособности выражали как процент жизнеспособности в контроле с носителем (за вычетом фонового поглощения).
Анализ остеогенной дифференцировки МСК
Анализ остеогенной дифференцировки МСК проводили с использованием набора Osteogenic Differentiation bulletKit® (Lonza). МСК культивировали по 200000 клеток/лунку в 6-луночных планшетах до слияния. Затем среду для выращивания стволовых клеток заменяли остеогенной средой, поставляемой с ОА и BMP2 или без них. После семи дней культивирования проводили окрашивание щелочной фосфатазой (ALP), выделение РНК и белка, как описано в наших опубликованных протоколах 20 .
ОТ-ПЦР в реальном времени
кДНК синтезировали из 1 мкг тотальной РНК с использованием набора для обратной транскриптазы SuperScript III (Invitrogen) в конечном объеме 20 мкл. Праймеры были разработаны с помощью инструмента для проектирования праймеров IDT SCI (Integrated DNA Technologies, Сан-Диего, Калифорния). Эксперименты ОТ-ПЦР проводили с помощью термоциклера Bio-Rad C1000 (Bio-Rad, Hercules, CA), а эксперименты ПЦР в реальном времени проводили с призмой ABI 7500 (Applied Biosystems, Гранд-Айленд, Нью-Йорк) в трех повторностях.Последовательности для каждой пары праймеров были следующими: Hes1, прямой праймер 5′-TTCCTCCTCCCCGGTGGCTG-3′, обратный праймер 5′-TGCCCTTCGCCTCTTCTCCA-3′; ALP, прямой праймер 5′-GGGCATTGTGACTACCACTC-3′, обратный праймер 5′-AGTCAGGTTGTT CCGATTCA-3′; Runx2, прямой праймер 5′-CACTGCCACCTCTGACTTCT-3′, обратный праймер 5′-CACCATCATTCTGGTTAGGC-3′; остеокальцин (ОС), прямой праймер 5′-TGGCCATGCTGACTGCAGCC-3′, обратный праймер 5′-TGGGTAGGCGTCCCCCATGG-3′; остеопонтин (OPN), прямой праймер 5′-AAGGAACCAAAGCATCAAGAATTAG-3′, обратный праймер 5′-AGATGTCATCAGGCAGCTTGAC-3′; Коллаген I типа (Col1a1), прямой праймер 5′-GTTTGGCCTGAAGCAGAGAC-3′, обратный праймер 5′-TCTAAATGGGCCACTTCCAC-3′; β-актин, прямой праймер 5′-ACCACAGTCCATGCCATCAC-3′; обратный праймер 5′-TCCACCACCC TGTTGCTGTA-3′.Образцы анализировали в трех повторностях, а исходные данные состояли из номеров циклов ПЦР, необходимых для достижения порогового уровня флуоресценции. Относительный уровень экспрессии генов-мишеней нормализовали по гену β-актина 23 .
Опосредованная лентивирусом активация Notch
кДНК, кодирующие Notch2-NICD человека, были клонированы в лентивирусный вектор EF.v-CMV и проверена последовательность. Получение и концентрирование лентивируса осуществляли, как описано ранее 24 . Короче, ВСВ.G-псевдотипированные рекомбинантные лентивирусы получали путем транзиторной трансфекции трансдуцирующего вектора в 293 Т-клетки вместе с двумя упаковывающими векторами: pMD.G, плазмидой, экспрессирующей оболочку VSV.G, и pCMVΔR8.91 (Invitrogen, Карлсбад, Калифорния, США). ), содержащие гены HIV-1 gag / pol , tat и rev (соотношение 1,5 мкг: 2,0 мкг: 0,5 мкг этих трех векторов). Вирусные супернатанты собирали через 24, 48 и 72 часа после трансфекции и концентрировали с использованием фильтрационных колонок (Centricon Plus-20, отсечение по молекулярной массе = 100 кДа; Millipore, Бедфорд, Массачусетс, США).Для лентивирусной инфекции 10 мкл МСК высокой плотности (10 000 клеток/мл) высевали в 6-луночные планшеты и инкубировали в течение двух часов при 37°C перед добавлением остеогенной среды, содержащей лентивирус NICD1 и 8 мкг/мл полибрена. GFP-лентивирус использовали в этом эксперименте в качестве контроля. Зараженные культуры МСК собирали на седьмой день для окрашивания ALP, выделения белка и РНК.
Вестерн-блот-анализ
МСК, культивированные с обработкой ОА и BMP2 или без нее, лизировали в буфере RIPA (10 мМ Трис-HCl, 1 мМ ЭДТА, 1 % додецилсульфат натрия [SDS], 1 % NP-40, 1 : 100 коктейль ингибиторов протеиназ, 50 мМ β-глицерофосфата, 50 мМ фторида натрия).Образцы разделяли в полиакриламидном геле с 10% SDS и переносили на мембраны из поливинилидендифторида (PVDF) с помощью аппарата для полусухого переноса (Bio-Rad). Мембраны промокали 5% обезвоженным молоком в течение двух часов, а затем инкубировали с первичными антителами в течение ночи. Иммунные комплексы инкубировали с антикроличьим или мышиным IgG, конъюгированным с пероксидазой хрена (Promega, США), и визуализировали с помощью реактивов SuperSignal (Pierce, США). Использовали первичные поликлональные антитела против NICD1 и фосфор-smad1/5/8 (Cell Signaling, США).Мы также использовали первичные моноклональные антитела для обнаружения белка домашнего хозяйства, β-актина (Sigma-Aldrich, США).
Анализ эктопического костеобразования in vivoВсе исследования на животных были рассмотрены и одобрены Комитетом по этике животных Центра медицинских наук Университета штата Луизиана. Всего 1,0 × 10 6 МСК повторно суспендировали в 80 мкл среды для выращивания МСК, содержащей 20 мкМ M OA, и осторожно смешивали с 50 мг порошка гидроксиапатита (HA) (Himed).Затем композиты центрифугировали в течение двух минут при 200 об/мин с образованием осадка МСК/ГК. Для операции по формированию эктопической кости десять 8-недельных мышей NOD.CB17 -Prkdcscid/J (Charles River) (до 2 имплантатов на каждое животное) подвергали анестезии, а кожу спины очищали 70% этанолом. На противоположных сторонах спины выполняли два разреза длиной ~1 см, а затем тупым путем формировали карман. Наконец, были имплантированы гранулы MSC/HA. Через шесть недель после операции трансплантированные гранулы СККМ/ГК собирали для общего наблюдения и окрашивания трихромом по Массону.Иммуногистохимическое (ИГХ) окрашивание проводили с использованием антитела против остеопонтина (7C5h22, Abcam, США) в соответствии с нашими опубликованными протоколами 23 . Все работы с животными проводились в соответствии с утвержденными учреждением инструкциями.
Статистический анализ
Все эксперименты были независимо повторены не менее трех раз. Данные были представлены как среднее ± sd. Статистическую значимость среди групп оценивали с помощью однофакторного дисперсионного анализа. Уровень значимости р < 0.05.
Олеаноловая кислота 0041 S — Олеанан
идентификация
Астрантиагенин С
Кариофиллин
3-бета-гидроксиолеан-12-ен-28-овая кислота
спецификация
Аналитический стандарт олеаноловой кислоты с абсолютным массовым анализом для использования в количественном титровании.
Чистота (ВЭЖХ) ≥99% (Данный продукт доступен с хроматограммой ВЭЖХ)
Температура плавления: 300-310°C
библиография
Монография
2463EP / Стебель Clematis armandii
2013
Монография
2439EP / Плодоношение обыкновенное самоисцеляющееся
2013
хранилище
Хранить при: <+8°C
Хранить в сухом и защищенном от света месте.
Синтез и противоопухолевое действие конъюгатов фторурацил-олеаноловая кислота/урсоловая кислота/глицирретиновая кислота
В связи с очевидными побочными эффектами 5-фторурацила, ограничивающими его клиническую полезность, и с учетом различной биологической активности пентациклических тритерпенов было синтезировано двенадцать конъюгатов пентациклический тритерпен-5-фторурацил и оценена их противоопухолевая активность.Результаты показали, что все гибриды, нацеленные на одиночную замену ( 7a–12a ), обладали гораздо лучшей антипролиферативной активностью, чем гибриды, нацеленные на двойную замену ( 7b–12b ). Гибрид 12а проявлял хорошую антипролиферативную активность в отношении всех протестированных клеточных линий МЛУ. Кроме того, было обнаружено, что 12a может индуцировать приток внутриклеточного кальция, генерацию АФК, останавливать пролиферацию клеток в фазе G1 и активировать апоптическую сигнальную каспазу-8, которая в конечном итоге активирует апоптотический эффектор каспазу-3 и вызывает позже ядерный апоптоз.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуй снова? .
 Также доступны более темные экстракты, которые могут придать дополнительный оттенок конечному составу продукта. При проглатывании порошок инулина, содержащийся в продукте, может иметь пробиотические эффекты, которые со временем улучшают здоровье пищеварительной системы.
Также доступны более темные экстракты, которые могут придать дополнительный оттенок конечному составу продукта. При проглатывании порошок инулина, содержащийся в продукте, может иметь пробиотические эффекты, которые со временем улучшают здоровье пищеварительной системы. Присмотритесь к товарам и найдите лучших поставщиков, которые могут доставить в любом необходимом количестве.
Присмотритесь к товарам и найдите лучших поставщиков, которые могут доставить в любом необходимом количестве. ..................... 8
1.1 Получение лупеола .......................................... 9
1.2 Реакции по гидроксильной группе ........................... 10
1.2.1 Эфиры лупеола ...................................... 10
1.2.2 Окисление .......................................... 15
1.3 Реакции с модификацией изопренильного фрагмента ........... 20
..................... 8
1.1 Получение лупеола .......................................... 9
1.2 Реакции по гидроксильной группе ........................... 10
1.2.1 Эфиры лупеола ...................................... 10
1.2.2 Окисление .......................................... 15
1.3 Реакции с модификацией изопренильного фрагмента ........... 20
 ....... 44
2.2.3 Синтез и химические превращения цианэтильных
производных ........................................ 48
2.2.4 Окисление .......................................... 54
2.2.5 Реакции по альдегидной группе ...................... 63
2.3 Реакции с модификацией изопренильного фрагмента ........... 71
2.3.1 Синтез 30-производных .............................. 71
2.3.1.1 Введение электроноакцепторного заместителя в
положение 30 ................................... 71
2.3.1.2 Синтез 30-аминопроизводных ..................... 73
2.3.1.3 Синтез 30-триазолилпроизводных ................. 76
2.3.2 Реакции по двойной связи ........................... 79
2.3.3 Синтез норлупанов .................................. 85
2.4 Модификация циклов производных бетулина ................... 91
2.4.1 Модификация по кольцу А ..................
....... 44
2.2.3 Синтез и химические превращения цианэтильных
производных ........................................ 48
2.2.4 Окисление .......................................... 54
2.2.5 Реакции по альдегидной группе ...................... 63
2.3 Реакции с модификацией изопренильного фрагмента ........... 71
2.3.1 Синтез 30-производных .............................. 71
2.3.1.1 Введение электроноакцепторного заместителя в
положение 30 ................................... 71
2.3.1.2 Синтез 30-аминопроизводных ..................... 73
2.3.1.3 Синтез 30-триазолилпроизводных ................. 76
2.3.2 Реакции по двойной связи ........................... 79
2.3.3 Синтез норлупанов .................................. 85
2.4 Модификация циклов производных бетулина ................... 91
2.4.1 Модификация по кольцу А ..................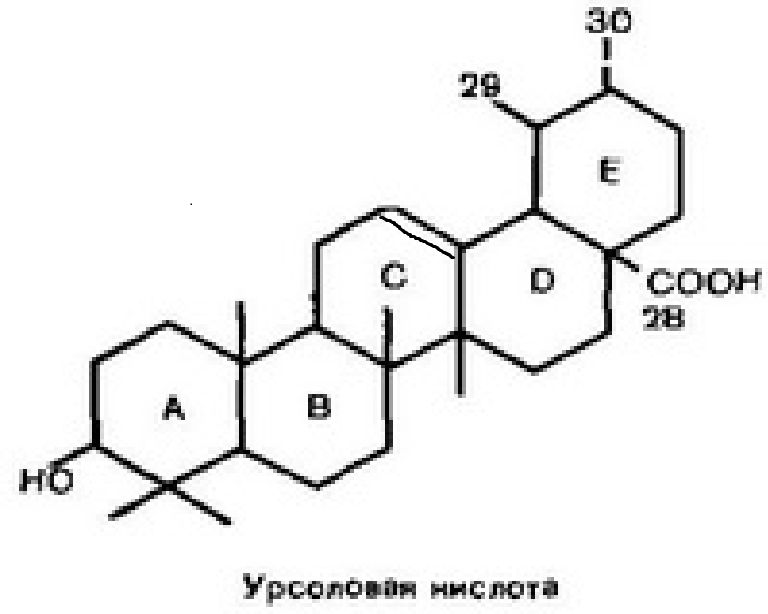
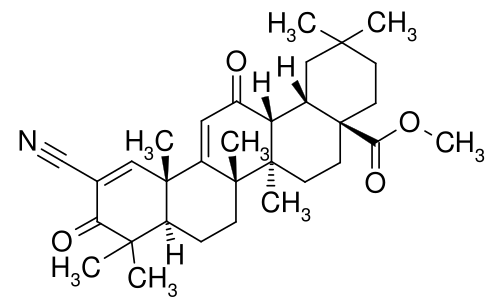 ............. 143
3.3.2 Гидразиды бетулиновой кислоты и ее производных .... 146
3.3.3 Карбаматы и уреиды бетулиновой кислоты и ее
производных ....................................... 148
3.4 Реакции с модификацией изопренильного фрагмента .......... 152
3.5 Модификация по кольцу А производных бетулиновой кислоты .. 157
3.6 Химические трансформации производных бетулиновой
кислоты, протекающие с изменением углеродного скелета .... 170
ГЛАВА 4. ОЛЕАНОЛОВАЯ КИСЛОТА .................................. 184
4.1 Получение олеаноловой кислоты ............................ 185
4.2 С-3-, C-28-Производные олеаноловой кислоты ............... 187
4.2.1 Эфиры олеаноловой кислоты и ее производных ........ 187
4.2.2 Амиды олеаноловой кислоты и ее производных ........ 197
4.3 Реакции по двойной связи ................................. 201
4.4 Модификация остова производных олеаноловой кислоты .
............. 143
3.3.2 Гидразиды бетулиновой кислоты и ее производных .... 146
3.3.3 Карбаматы и уреиды бетулиновой кислоты и ее
производных ....................................... 148
3.4 Реакции с модификацией изопренильного фрагмента .......... 152
3.5 Модификация по кольцу А производных бетулиновой кислоты .. 157
3.6 Химические трансформации производных бетулиновой
кислоты, протекающие с изменением углеродного скелета .... 170
ГЛАВА 4. ОЛЕАНОЛОВАЯ КИСЛОТА .................................. 184
4.1 Получение олеаноловой кислоты ............................ 185
4.2 С-3-, C-28-Производные олеаноловой кислоты ............... 187
4.2.1 Эфиры олеаноловой кислоты и ее производных ........ 187
4.2.2 Амиды олеаноловой кислоты и ее производных ........ 197
4.3 Реакции по двойной связи ................................. 201
4.4 Модификация остова производных олеаноловой кислоты .
 ........ 273
6.6 Химические трансформации производных урсоловой кислоты,
протекающие с изменением углеродного скелета ............. 285
ГЛАВА 7. ГЛИЦИРРЕТОВАЯ КИСЛОТА ................................ 287
7.1 Получение глицирретовой кислоты .......................... 288
7.2 С-3-, C-30-Производные глицирретовой кислоты ............. 290
7.2.1 Эфиры глицирретовой кислоты и ее производных ...... 290
7.2.2 Амиды глицирретовой кислоты и ее производных ...... 298
7.2.3 Другие С-3-, C-30-производные глицирретовой
кислоты ........................................... 306
7.3 Восстановление производных глицирретовой кислоты ......... 310
7.4 Модификация функциональных групп остова производных
глицирретовой кислоты .................................... 323
7.5 Химические трансформации производных глицирретовой
кислоты, протекающие с изменением углеродного скелета ....
........ 273
6.6 Химические трансформации производных урсоловой кислоты,
протекающие с изменением углеродного скелета ............. 285
ГЛАВА 7. ГЛИЦИРРЕТОВАЯ КИСЛОТА ................................ 287
7.1 Получение глицирретовой кислоты .......................... 288
7.2 С-3-, C-30-Производные глицирретовой кислоты ............. 290
7.2.1 Эфиры глицирретовой кислоты и ее производных ...... 290
7.2.2 Амиды глицирретовой кислоты и ее производных ...... 298
7.2.3 Другие С-3-, C-30-производные глицирретовой
кислоты ........................................... 306
7.3 Восстановление производных глицирретовой кислоты ......... 310
7.4 Модификация функциональных групп остова производных
глицирретовой кислоты .................................... 323
7.5 Химические трансформации производных глицирретовой
кислоты, протекающие с изменением углеродного скелета ....

 ) Raeusch .; Hemsleya chinensis когн.
) Raeusch .; Hemsleya chinensis когн.
 1 NG / ML
1 NG / ML 7 NG H / ML
7 NG H / ML 78 NG / ML
78 NG / ML