Трансген — это… Что такое Трансген?
трансген — Ген, перенесённый в клетку методами рекомбинантных ДНК [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN transgene … Справочник технического переводчика
Трансген — Крайний слева цветок дикий тип, ядра двух других цветков содержат трансген, мРНК которого вызывают постранскрипционный сайленсинг гена, отв … Википедия
трансген — transgenas statusas T sritis augalininkystė apibrėžtis Genas, išskirtas iš vieno organizmo ir perkeltas į kitą organizmą ar ląstelę genų inžinerijos metodu. atitikmenys: angl. transgene rus. трансген … Žemės ūkio augalų selekcijos ir sėklininkystės terminų žodynas
ТРАНСГЕННЫЕ ЖИВОТНЫЕ — ТРАНСГЕННЫЕ ЖИВОТНЫЕ, экспериментально полученные животные, содержащие во всех клетках своего организма дополнительную интегрированную с хромосомами и экспрессирующуюся чужеродную ДНК (трансген), которая передается по наследству по законам… … Энциклопедический словарь
Биотехнологии — Биотехнология интеграция естественных и инженерных наук, позволяющая наиболее полно реализовать возможности живых организмов или их производные для создания и модификации продуктов или процессов различного назначения. Чаще всего применяется в… … Википедия
Чаще всего применяется в… … Википедия
ген селектируемый — * ген селекцыйны * selected gene ген, обеспечивающий клетке возможность выживания на определенной селективной среде, напр., в присутствии антибиотиков. Ген селектор * ген селектар * selector gene ген, контролирующий развитие отдельных блоков… … Генетика. Энциклопедический словарь
геномная библиотека банк генов — геномная библиотека, банк генов * геномная бібліятэка, банк генаў * genomic library or gene bank набор клонированных фрагментов ДНК, представляющих индивидуальный (групповой, видовой) геном. У млекопитающих (в т. ч. человека) геномы крупные,… … Генетика. Энциклопедический словарь
Селекция — (лат. selectio выбирать) наука о создании новых и улучшении существующих пород животных, сортов растений, штаммов микроорганизмов. Селекцией называют также отрасль сельского хозяйства, занимающуюся выведением новых сортов и гибридов… … Википедия
РНК интерференция — Фермент siRNA или microRNA. Эти процессированные РНК попадают в RNA induced silencing complex (RISC), который разрушает mRNA и предотвращает трансляцию.[1] РНК интерференция (RNAi) это механизм подавления экспрессии гена, то есть проявления… … Википедия
Эти процессированные РНК попадают в RNA induced silencing complex (RISC), который разрушает mRNA и предотвращает трансляцию.[1] РНК интерференция (RNAi) это механизм подавления экспрессии гена, то есть проявления… … Википедия
РНК — интерференция — Фермент siRNA или microRNA. Эти процессированные РНК попадают в RNA induced silencing complex (RISC), который разрушает mRNA и предотвращает трансляцию.[1] РНК интерференция (RNAi) это механизм подавления экспрессии гена, то есть проявления… … Википедия
мир «подсел» на трансгены, Россия на очереди :: Общество :: РБК
Показательно и то, что ГМ-растения, даже коммерческих сортов, далеко не всегда отвечают заявленным производителями характеристикам. Так, порой внедренные в них гены «замолкают», попросту не работают, или трансгенные растения наряду с одним полезным признаком приобретают другой, но уже негативный. Например известно, что устойчивый к колорадскому жуку картофель значительно быстрее гниет при хранении.
Противники ГМО оперируют печальной статистикой о том, что, к примеру, в Индии возросло число самоубийств среди фермеров, которые стали проращивать ГМ-семена и столкнулись с проблемой их бесплодности. Понятно, что причиной суицидов было не низкое качество семян само по себе, а навалившееся на несчастных банкротство, ведь трансгенные семена стоят в несколько раз дороже традиционных аналогов, и фермеры надеялись на соответствующую отдачу.
Читайте на РБК Pro
Директор Общенациональной ассоциации генетической безопасности (ОАГБ) Елена Шаройкина разделяет распространенное мнение о том, что развитие ГМО выгодно прежде всего транснациональным корпорациям, которые продают не только ГМ-семена, но и специальные пестициды к ним, подсаживая своих покупателей на «ГМ-иглу». Кроме того, ТНК получают значительные лицензионные отчисления за семена, так как те являются авторской собственностью.
Несовершенные технологии
Основной тезис приверженцев идеи разумной предосторожности состоит в том, что опасность представляет не генная инженерия как таковая, а несовершенные методы, которые используются на нынешнем этапе. «Проблема в том, что методы и технологии, с помощью которых сегодня получают ГМ-сорта растений, несовершенны. Для получения ГМ растений надо взять какой-то фрагмент ДНК из бактерии или насекомого и вставить его в геном обычного растения, чтобы изменить какое-то его свойство. Однако чужеродный фрагмент ДНК (ген) встраивается в геном абсолютно вслепую. Генный инженер не знает, куда этот фрагмент встроится и какими изменениями в работе генома эта трансформация будет сопровождаться», — рассказывает В.Кузнецов. Ученый поясняет, что «геном любого живого организма – это сложнейшая машина», а если чужеродный ген, который также представляет собой информационную программу, встанет в одно место цепочки ДНК, то получится положительный эффект, в другое — отрицательный, в третье — вообще никакого эффекта не будет. Именно по этой причине ни один из производителей ГМО не может предсказать заранее все свойства рукотворного сорта, «но на всякий случай говорит, что они безопасные», отмечает В.Кузнецов. Он добавляет, что методы оценки безопасности ГМ-растений существуют, но они достаточно дороги и требуют дальнейшего усовершенствования.
«Проблема в том, что методы и технологии, с помощью которых сегодня получают ГМ-сорта растений, несовершенны. Для получения ГМ растений надо взять какой-то фрагмент ДНК из бактерии или насекомого и вставить его в геном обычного растения, чтобы изменить какое-то его свойство. Однако чужеродный фрагмент ДНК (ген) встраивается в геном абсолютно вслепую. Генный инженер не знает, куда этот фрагмент встроится и какими изменениями в работе генома эта трансформация будет сопровождаться», — рассказывает В.Кузнецов. Ученый поясняет, что «геном любого живого организма – это сложнейшая машина», а если чужеродный ген, который также представляет собой информационную программу, встанет в одно место цепочки ДНК, то получится положительный эффект, в другое — отрицательный, в третье — вообще никакого эффекта не будет. Именно по этой причине ни один из производителей ГМО не может предсказать заранее все свойства рукотворного сорта, «но на всякий случай говорит, что они безопасные», отмечает В.Кузнецов. Он добавляет, что методы оценки безопасности ГМ-растений существуют, но они достаточно дороги и требуют дальнейшего усовершенствования.
Директор Института физиологии растений обращает внимание на то, что механизмы обмена генной информацией вполне естественны и заложены самой природой. Однако в естественных условиях обмен генетической информацией между родительскими формами происходит несколько иначе. В качестве примера В.Кузнецов привел генетический обмен между людьми. «В процессе размножения родители обмениваются генетической информацией, это приводит к тому, что ребенок имеет признаки и отца и матери. Происходит обмен информацией между ДНК родителей, причем не как заблагорассудится, а по определенным участкам генома, которые имеют высокую степень гомологии. Ген, отвечающий за цвет волос, не может обменяться с геном, отвечающим, например, за цвет глаз. Обмен идет только между теми фрагментами цепочки ДНК, которые отвечают за один и тот же признак», — поясняет ученый. Однако в случае с ГМО ген встраивается не в строго определенное место, как требует того природа, а где ему заблагорассудится.
По словам Е.Шаройкиной, нельзя утверждать, что ГМО негативно влияют на здоровье человека, однако нельзя и не обратить внимание на то, что, например, в США, где ГМ-продукция получила широкое распространение, многие болезни «помолодели», а проблема ожирения приняла форму пандемии. По ее словам, коммерциализация продукции, безопасность которой не доказана, представляется довольно сомнительной идеей, «а так как опыты на человеке ставить нельзя, то в итоге проводится эксперимент над человечеством в целом».
По ее словам, коммерциализация продукции, безопасность которой не доказана, представляется довольно сомнительной идеей, «а так как опыты на человеке ставить нельзя, то в итоге проводится эксперимент над человечеством в целом».
По мнению противников ГМ, еще одна проблема связана с перекрестным опылением, что приводит к мутации сорняков и необходимости создавать новые ГМ-сорта и все более мощные химикаты. Однако сторонники трансгенных технологий уверяют, что свести этот риск к минимуму можно, если строго соблюдать технологические требования к выращиванию ГМ-растений.
Живые гомункулы
В открытых источниках информации много рассказывают о модифицированных растениях с генами рыб, скорпионов и прочей живности. Однако, как отмечают эксперты, таких сортов совсем немного. По словам В.Кузнецова, более 70% всех посевных площадей в мире, занятых трансгенными сортами, — это территории, на которых выращиваются сорта, устойчивые к гербицидам.
Вторая распространенная группа ГМ-сортов – это растения, устойчивые к листогрызущим насекомым, например, к колорадскому жуку. Их доля составляет примерно 28% от занятых ГМ-сортами территорий. И всего порядка 1% площадей приходится на растения с другими измененными признаками, такими как устойчивость к вирусным заболеваниям, более высокая продуктивность, лучшее качество урожая и др.
Их доля составляет примерно 28% от занятых ГМ-сортами территорий. И всего порядка 1% площадей приходится на растения с другими измененными признаками, такими как устойчивость к вирусным заболеваниям, более высокая продуктивность, лучшее качество урожая и др.
В итоге складывается парадоксальная ситуация — трансгенных сортов растений много, но нет ни одного коммерческого сорта, устойчивого к засухе, к низкой температуре, к засолению почвы и высоким концентрациям в ней тяжелых металлов.
Банановая терапия
Кроме решения продовольственной проблемы, ГМ-растениям пророчат и другие возможные применения. Одной из таких потенциальных возможностей является наделение плодов лекарственными свойствами. В свое время генные инженеры вели активные разработки для внедрения вакцин и лекарств в овощи и фрукты. Предполагалось, что таким образом откушав, например, один банан, можно будет обеспечить себе иммунитет к вирусу гриппа. Однако эта идея так и не получила коммерческого распространения, хотя она еще не отброшена учеными окончательно.
Директор Института физиологии растений РАН В.Кузнецов обращает внимание на то, что такие «лечебные» овощи и фрукты, если они появятся в продаже, нужно будет принимать очень осторожно. «Даже если бы у нас, чисто гипотетически, продавались бананы, вызывающие иммунитет к гриппу, то нужно понимать, что это лекарство, с ним нужна осторожность, нужно знать дозу и вообще понимать, с чем имеешь дело», — говорит ученый.
ГМО в России
В нашей стране ГМ-растения стремительно распространяются, несмотря на запрет в отношении ввоза модифицированных семян и трансгенных продуктов, не включенных в перечень разрешенных. Официально ввезти на территорию РФ можно только пять видов сельхозкульур: картофель, сою, рис, кукурузу и сахарную свеклу. По словам А.Злочевского, зарубежная ГМ-продукция зачастую декларируются на границе как натуральная.
Что касается ГМ-семян, то россияне, как правило, получают сою из Китая, кукурузу — из Украины. В братской республике ГМ-оборот тоже запрещен, но масштабы нелегального рынка ГМО там еще значительнее, чем в РФ. Говоря о безопасности этих растений, А.Злочевский отметил, что речь идет о тех семенах, которые апробированы и высеваются в других странах. «При соблюдении технологических критериев, опасности они не представляют», — заверяет он. Например, технологические критерии предписывают, чтобы вокруг полей, засеянных ГМ-растениями, были созданы зоны отчуждения. А так как никто внутри страны оборот ГМ-сортов не контролирует, не удивительно, что зачастую технологические требования просто не выполняются, нанося вред экологической ситуации.
Об отсутствии полноценной проверки модифицированных сырья, семян или продуктов в России говорит и руководитель ОАГБ. В качестве примера она привела Европу, где помимо государственных проверок широко распространена система добровольной сертификации и общественный контроль. Европейское законодательство предписывает маркировать продукцию, в составе которой содержится более 0,5% ГМО. И производители, не желая рисковать своей репутацией, честно «маркируются», если используют ГМ-составляющие.
Европейское законодательство предписывает маркировать продукцию, в составе которой содержится более 0,5% ГМО. И производители, не желая рисковать своей репутацией, честно «маркируются», если используют ГМ-составляющие.
В России закон о защите прав потребителей требует маркировать продукт, содержащий свыше 0,9% ГМО. Но, по словам Е.Шаройкиной, сотрудники ее организации, регулярно проводящие проверки московских прилавков, ни разу не встречали ни одной «честной» упаковки. В то же время она отмечает позитивные тенденции на столичных прилавках. «За последние 3 года за все проверки, которые мы проводили в Москве, мы не находили ГМО в продуктах. Рынок за это время на предмет содержания ГМО существенно очистился. Мы, конечно, не можем себе позволить массовые исследования, но даже наша небольшая выборка показывает, что на московском рынке ГМО стало существенно меньше», — говорит эксперт.
Альтернативы – здоровые и не очень
И экспертам, и простому потребителю становится совершенно ясно, что оградить себя от ГМО в современном мире практически невозможно. Предположим, что Россия полностью закроется от ГМО и обратится к старой доброй селекции. Будет ли это выходом из ситуации? Самым щадящим методом селекции можно назвать скрещивание, которое основано на биологическом подходе: обмен генной информацией происходит между гомологичными генами. Другие методы, не менее распространенные, уже вызывают опасения. В частности, селекция пользуется такими способами, как воздействие химии и радиации, для того, чтобы изменить генную структуру растения. В результате изменяется множество генов, и такой «мутант» вряд ли будет безопаснее ГМ-растения.
Предположим, что Россия полностью закроется от ГМО и обратится к старой доброй селекции. Будет ли это выходом из ситуации? Самым щадящим методом селекции можно назвать скрещивание, которое основано на биологическом подходе: обмен генной информацией происходит между гомологичными генами. Другие методы, не менее распространенные, уже вызывают опасения. В частности, селекция пользуется такими способами, как воздействие химии и радиации, для того, чтобы изменить генную структуру растения. В результате изменяется множество генов, и такой «мутант» вряд ли будет безопаснее ГМ-растения.
Что могут сделать люди, не желающие иметь ничего общего с ГМО? О, им придется сильно напрячься! Нужно будет, как минимум, отказаться от продуктов, которые могут содержать в себе картофель, рис, сою, свеклу или кукурузу. Ведь мы помним, что в России разрешено использовать некоторые из ГМ-сортов этих растений. Еще один вариант — покупать только органическую еду. Но и с этим будут сложности. В России нет законодательства об экологическом сельском хозяйстве, поэтому заверениям производителя о чистоте продукта придется верить на слово. Кроме того, даже в мегополисах трудно найти эко-продукты. Например, в Москве существуют только два специализированных магазина и несколько эко-прилавков в дорогих супермаркетах. То, что organic food — удовольствие дорогостоящее, объяснять не приходится, причем цены могут быть в разы выше массового сегмента.
Кроме того, даже в мегополисах трудно найти эко-продукты. Например, в Москве существуют только два специализированных магазина и несколько эко-прилавков в дорогих супермаркетах. То, что organic food — удовольствие дорогостоящее, объяснять не приходится, причем цены могут быть в разы выше массового сегмента.
Можно, конечно, покупать овощи и кое-какие сезонные фрукты у бабушек. Но, опять же, в России никто не контролирует семенной фонд, поэтому не исключено, что и бабушка, сама того не ведая, использовала ГМ-семена.
Остается один единственно верный способ – завести свое подсобное хозяйство и на 100% обеспечивать себя продовольствием. Ну и ждать, пока трансгенные мутанты-растения поработят наш мир! Ведь только искренняя уверенность в таком исходе событий сможет заставить человечество бескомпромиссно бороться с ГМО.
Вероника Ичеткина, РБК
МИФ О ТРАНСГЕННОЙ УГРОЗЕ | Наука и жизнь
Площади (в млн га), занимаемые трансгенными культурами во всем мире.
Общая площадь насаждений (в млн га) в 2002 году и доля в ней трансгенных растений.
Демонстрация противников генетически модифицированных растений в Лондоне.
Соя — древнейшее культурное растение семейства бобовых.
Этикетка на продуктах, содержащих трансгенную сою.
Маркировки, обозначающие отсутствие генетически модифицированных компонентов в продукте.
Томатное пюре — первый генетически модифицированный пищевой продукт, появившийся в Европе в продаже (в 1996 году).
‹
›
Писать про генетически модифицированные растения сегодня модно, как раньше было модно бороться с пестицидами и нитратами. Кто-то пишет, что эти растения — порождение биологического оружия, кто-то — что экспериментальные мутации опасны для здоровья человека. Ситуация с отношением общества к генетически модифицированным растениям усугубляется еще и невысокой образованностью населения в области биологии: одно слово «трансгенный» вызывает страх. По этому поводу среди ученых-биотехнологов бытует анекдот: «Люди думают, что трансгенная пища вредна тем, что в ней есть гены, а зато в обычных продуктах никаких генов нет».
По этому поводу среди ученых-биотехнологов бытует анекдот: «Люди думают, что трансгенная пища вредна тем, что в ней есть гены, а зато в обычных продуктах никаких генов нет».
Эта статья не агитирует за употребление в пищу трансгенных продуктов или за приобретение трансгенных сортов, если они все же появятся в продаже. Пусть этот вопрос решают производители сельскохозяйственной продукции, взвешивая плюсы и минусы новой технологии. Это — небольшой ликбез, чтобы население представляло себе, что такое трансгенные растения и продукты из них, могут ли они быть опасными или нет, и не шарахалось в сторону от упаковок в супермаркете, на которых стоит пометка «содержит генетически модифицированные компоненты».
ЗАЧЕМ НУЖНА ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ РАСТЕНИЙВсю историю сельского хозяйства (около 10 000 лет) человек для своей пользы улучшал животных и растения. Вначале селекция была основана на явлении естественной генетической изменчивости, позже люди научились искусственно создавать комбинативную изменчивость (гибридизация), а в последние десятилетия — и мутационную (мутагенез). Принцип селекции всегда оставался неизменным — отбор ценных генотипов. Результат известен — современные виды капусты совершенно непохожи на своих далеких предков, а початки кукурузы сегодня примерно в 10 раз больше тех, что выращивались 5 тысяч лет назад. К сожалению, кпд селекции очень низок — из тысяч и десятков тысяч исходных растений селекционер выводит всего один-два сорта.
Принцип селекции всегда оставался неизменным — отбор ценных генотипов. Результат известен — современные виды капусты совершенно непохожи на своих далеких предков, а початки кукурузы сегодня примерно в 10 раз больше тех, что выращивались 5 тысяч лет назад. К сожалению, кпд селекции очень низок — из тысяч и десятков тысяч исходных растений селекционер выводит всего один-два сорта.
Чем же отличается генная инженерия растений (ГИР) от обычной селекции? При селекции перенос генов осуществляется только между близкородственными растениями, генная инженерия же позволяет перенести в растение гены из любого организма. Для чего это делается? Растения с «чужими» генами приобретают устойчивость к гербицидам, вредителям и патогенам, их плоды способны долго храниться при комнатной температуре, имеют повышенную питательную ценность или другой вкус, и, наконец, они способны синтезировать новые вещества — начиная от лекарств и заканчивая пластиком.
Направленной генетической модификации (трансформации) можно подвергать не только растения, а любые живые организмы. Первые трансгенные микроорганизмы были получены в начале 70-х, а первые трансгенные сельскохозяйственные растения и животные появились значительно позже — в середине 80-х. Трансгенные микроорганизмы, к примеру, широко используются в фармацевтической и пищевой промышленности. Такие препараты, как инсулин, интерферон, интерлейкин, в основном получают генно-инженерным способом. Сегодня с применением методов генной инженерии выпускается около 25% всех лекарств в мире. Некоторые генетически модифициро ванные микробы эффективно перерабатывают промышленные отходы. Трансгенные животные чаще всего используются в качестве биореакторов — продуцентов нужных белков, в основном лекарственных препаратов или ферментов для пищевой промышленности. Например, в России выведена порода овец, вырабатывающих вместе с молоком и фермент, необходимый в производстве сыра. В ближайшей перспективе — использование трансгенных животных в качестве моделей для изучения наследственных заболеваний человека, а также в качестве источников органов и тканей для трансплантологии.
Первые трансгенные микроорганизмы были получены в начале 70-х, а первые трансгенные сельскохозяйственные растения и животные появились значительно позже — в середине 80-х. Трансгенные микроорганизмы, к примеру, широко используются в фармацевтической и пищевой промышленности. Такие препараты, как инсулин, интерферон, интерлейкин, в основном получают генно-инженерным способом. Сегодня с применением методов генной инженерии выпускается около 25% всех лекарств в мире. Некоторые генетически модифициро ванные микробы эффективно перерабатывают промышленные отходы. Трансгенные животные чаще всего используются в качестве биореакторов — продуцентов нужных белков, в основном лекарственных препаратов или ферментов для пищевой промышленности. Например, в России выведена порода овец, вырабатывающих вместе с молоком и фермент, необходимый в производстве сыра. В ближайшей перспективе — использование трансгенных животных в качестве моделей для изучения наследственных заболеваний человека, а также в качестве источников органов и тканей для трансплантологии.
Но вернемся к трансгенным растениям. Современные гербициды значительно эффективнее и экологически безопаснее своих предшественников, но они действуют на всю растительность подряд, не разбираясь, где культурные растения, а где сорняки, поэтому ранее в основном использовались до высадки растений или после уборки урожая. С появлением технологии генетической трансформации стало возможным встраивать в растения гены, которые делают их нечувствительными к таким гербицидам. Таким образом, после обработки гербицидом сорняки гибнут, а трансгенные культуры — нет.
Для придания устойчивости к вредителям чаще всего используется ген Bt-токсина, выделенный из бактерии Bacillus thuringiensis. Препараты этой бактерии уже около 50 лет применяются в сельском хозяйстве в качестве безопасного для людей и животных биоинсектицида, но они быстро теряют активность, и поэтому их доля в мировом производстве инсектицидов составляет менее 2%. Токсин бактерии поражает кишечник вредителей, питающихся растениями, причем с очень высокой специфичностью. При встраивании гена растение начинает вырабатывать токсин самостоятельно. А значит, отпадает необходимость обработки культур опасными химическими инсектицида ми.
При встраивании гена растение начинает вырабатывать токсин самостоятельно. А значит, отпадает необходимость обработки культур опасными химическими инсектицида ми.
В 2002 году 75% всех выращиваемых трансгенных растений содержали ген устойчивости к гербицидам, 17% — ген устойчивости к вредителям и почти 8% — по два гена устойчивости. Но сегодня приоритеты в создании растений, обладающих теми или иными признаками, изменились. Если в 90-е годы в основном работали над растениями, обладающими полезными свойствами для их выращивания, — именно они сейчас и возделываются на полях, — то в настоящее время основной упор делается на улучшение потребительских свойств. По прогнозам, такие улучшенные культуры сменят растения, синтезирующие медикаменты, а их, в свою очередь, — растения-продуценты специфических химических соединений.
Генная инженерия растений развивается очень быстрыми темпами. Первое трансгенное, или генетически модифицированное , растение (ГМР) было получено в 1984 году, а через два года в США и во Франции уже проводились полевые испытания. Площади, занятые трансгенными растениями, стремительно возрастают: с 1,7 млн га в 1996 году, когда началось их возделывание в коммерческих масштабах, до 58,7 млн га в 2002 году, что составляло около 4,5% от всех пахотных площадей в мире. Причем 99% этой площади занимают четыре культуры: соя, хлопок, кукуруза и рапс. По этим растениям картина еще более впечатляющая — в среднем 22% их насаждений занимают трансгенные сорта. В 2002 году в США около 75% хлопка и cои, в Аргентине — 99% сои, в Канаде — 65% рапса, в Китае — 51% хлопка были трансгенными.
Площади, занятые трансгенными растениями, стремительно возрастают: с 1,7 млн га в 1996 году, когда началось их возделывание в коммерческих масштабах, до 58,7 млн га в 2002 году, что составляло около 4,5% от всех пахотных площадей в мире. Причем 99% этой площади занимают четыре культуры: соя, хлопок, кукуруза и рапс. По этим растениям картина еще более впечатляющая — в среднем 22% их насаждений занимают трансгенные сорта. В 2002 году в США около 75% хлопка и cои, в Аргентине — 99% сои, в Канаде — 65% рапса, в Китае — 51% хлопка были трансгенными.
ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЕ РАСТЕНИЯ. КТО ПРОТИВ И ПОЧЕМУ?
Вместе с ростом площадей, занятых ГМР, также набирало силу и движение протеста против этих растений и транснациональных корпораций, предлагающих их. Как правило, организации, выступающие за запрет трансгенных растений, действуют весьма эмоционально, не прислушиваясь ни к каким разумным доводам, имеют соответствующие громкие названия, в которых на все лады обыгрываются слова «биобезопасность» и «экология». Мир тоже, как и следовало ожидать, в отношении ГИР разделился на две части. За: мировой лидер в этой технологии — США и крупнейшие экспортеры сельскохозяйственной продукции — Канада, Аргентина, Австралия и другие; против: отсталые страны с экстенсивным земледелием и, как ни странно, Европа. Сопротивление Европы — один из главных козырей противников ГИР: дескать, европейцы не глупее американцев, а не хотят ни выращивать, ни даже закупать генетически модифицированную продукцию, значит, дело нечисто. В действительности тому есть экономические и политические причины. Первая, но не главная: в настоящее время 95% всех посевов ГМР — это нетипичные для Европы соя, кукуруза и хлопок. В Европе площади, засеянные этими (нетрансгенными) культурами, составляют всего лишь от 0,5% (соя) до 3% (кукуруза) от мировых площадей. Основная же причина в другом. Сельское хозяйство в Европе доведено до совершенства, что привело к кризису перепроизводства: за превышение квот штрафуют, за сокращение площадей доплачивают.
Мир тоже, как и следовало ожидать, в отношении ГИР разделился на две части. За: мировой лидер в этой технологии — США и крупнейшие экспортеры сельскохозяйственной продукции — Канада, Аргентина, Австралия и другие; против: отсталые страны с экстенсивным земледелием и, как ни странно, Европа. Сопротивление Европы — один из главных козырей противников ГИР: дескать, европейцы не глупее американцев, а не хотят ни выращивать, ни даже закупать генетически модифицированную продукцию, значит, дело нечисто. В действительности тому есть экономические и политические причины. Первая, но не главная: в настоящее время 95% всех посевов ГМР — это нетипичные для Европы соя, кукуруза и хлопок. В Европе площади, засеянные этими (нетрансгенными) культурами, составляют всего лишь от 0,5% (соя) до 3% (кукуруза) от мировых площадей. Основная же причина в другом. Сельское хозяйство в Европе доведено до совершенства, что привело к кризису перепроизводства: за превышение квот штрафуют, за сокращение площадей доплачивают. Зачем же европейцам нужны более продуктивные ГМР? Совершенство сельского хозяйства в Европе далось европейским государствам в буквальном смысле дорогой ценой: себестоимость европейской аграрной продукции намного выше мировой, а на дотации фермерам уходит около половины всего бюджета Евросоюза. Страны ЕС проводят единую протекционистскую сельскохозяйственную политику, которая давно стала объектом международной критики, особенно стран — экспортеров продовольствия, то есть как раз тех, что приняли генетически модифицированные (ГМ) культуры.
Зачем же европейцам нужны более продуктивные ГМР? Совершенство сельского хозяйства в Европе далось европейским государствам в буквальном смысле дорогой ценой: себестоимость европейской аграрной продукции намного выше мировой, а на дотации фермерам уходит около половины всего бюджета Евросоюза. Страны ЕС проводят единую протекционистскую сельскохозяйственную политику, которая давно стала объектом международной критики, особенно стран — экспортеров продовольствия, то есть как раз тех, что приняли генетически модифицированные (ГМ) культуры.
Запрет же на ввоз ГМР европейцы объясняют соображениями биологической безопасности, но страны-экспортеры, в основном США, заявляют, что это только повод для закрытия своих рынков. Представьте, что выращенные в странах третьего мира с благодатным климатом и дешевой рабочей силой трансгенные томаты, способные при обычной температуре храниться 2-3 месяца, самым дешевым морским путем повезут в Европу. Что тогда делать фермерам Италии и Испании, где выращивают 70% всех томатов, производимых в странах ЕС? Сельскохозяйственное лобби в Европе очень сильно, фермеры прекрасно организованы, и потому последствия нетрудно представить. Вот по этим причинам ГМР не пускают в Европу, а совсем не из-за «сознательности» европейцев или опасности трансгенных продуктов питания. Кстати, в «долгоиграющие» помидоры не пересаживают гены животных, впадающих в спячку, как пишут некоторые журналисты. В них всего лишь встроен собственный «помидорный» ген, блокирующий синтез фермента, ответственного за созревание плодов. Никаких новых «непомидорных» белков при этом не образуется.
Вот по этим причинам ГМР не пускают в Европу, а совсем не из-за «сознательности» европейцев или опасности трансгенных продуктов питания. Кстати, в «долгоиграющие» помидоры не пересаживают гены животных, впадающих в спячку, как пишут некоторые журналисты. В них всего лишь встроен собственный «помидорный» ген, блокирующий синтез фермента, ответственного за созревание плодов. Никаких новых «непомидорных» белков при этом не образуется.
Таким образом, анти-ГМР кампания в Европе имеет чисто экономическую подоплеку. И весь шум в печати, акции «зеленых», скорее всего, оплачиваются конкурентами производителей ГМР (возможно, «зеленые» даже не осознают этого). Понятно, почему «зеленые» совсем не протестуют против использования генной инженерии в фармацевтике, предпочитая «генно-инженерный» человеческий инсулин, полученный с помощью ГМ-микроорганизмов, «естественному» свиному.
Между прочим, Европа все последние годы все же закупает трансгенную сою (в качестве кормового белка), так как из-за эпизоотии «коровьего бешенства» от традиционно используемой мясо-костной муки фермерам поневоле пришлось отказаться. Более того, мало кто знает, что совсем недавно — в июле этого года — в странах ЕС закончился четырехлетний мораторий на лицензирование новых сортов трансгенных растений. В преддверии этого события в последние 2-3 года в Европе резко возросла интенсивность исследований в области создания новых ГМР, которые весьма дорогостоящи и невозможны без правительственной поддержки. Так что в ближайшее время в Европе следует ожидать появления новых ГМ-продуктов.
Более того, мало кто знает, что совсем недавно — в июле этого года — в странах ЕС закончился четырехлетний мораторий на лицензирование новых сортов трансгенных растений. В преддверии этого события в последние 2-3 года в Европе резко возросла интенсивность исследований в области создания новых ГМР, которые весьма дорогостоящи и невозможны без правительственной поддержки. Так что в ближайшее время в Европе следует ожидать появления новых ГМ-продуктов.
Россия же, как всегда, идет своим путем. С одной стороны, появление ГМР у нас
в стране должно только приветствоваться. Колорадский жук съедает треть урожая
картошки, потери от других вредителей, болезней и сорняков тоже очень велики,
а широко применяемые ядохимикаты вредны для здоровья, дороги да и используются
зачастую неэффективно. С другой стороны, закон, позволяющий выращивать трансгенные
растения, до сих пор не принят. А вот разрабатывать новые трансгенные сорта
и закупать генетически модифицированную продукцию разрешено. В Россию ввозят
трансгенную сою и кукурузу для использования в пищу или на корм животным, но…
выращивать их нельзя.
В Россию ввозят
трансгенную сою и кукурузу для использования в пищу или на корм животным, но…
выращивать их нельзя.
Средства массовой информации в разных странах также ведут себя по-разному. В отличие от Европы и нашей страны в США дебаты на страницах газет и журналов в основном ведутся не против трансгенных растений и гм-продуктов как таковых, а против недобросовестной деятельно сти отдельных компаний, пытающихся обойти установленные требования к ГМР. Но в целом и американские и европейские СМИ активно формируют негативное отношение в обществе к трансгенным растениям. Статьи о них часто грешат невежеством в области биологии. Даже такие газеты, как «New York Times» и лондонская «Times» (не говоря уже о менее респектабельных), в период с 1997 по 2000 год в статьях о ГМР в среднем только в 12% сообщений основывались на результатах научных исследований. С другой стороны, СМИ все чаще и чаще в качестве источников информации используют мнения различных экологических общественных организаций. Вот потому-то с легкой руки журналистов общественность узнала о «пище Франкенштейна», «продуктовом Чернобыле», «огородном джинне, который вырывается из бутылки». На полном серьезе печатают сообщения о трансгенных деревьях, подобно пушкинскому анчару выделяющих токсины и уничтожающих вокруг все живое; суперсорняках, не боящихся ни гербицидов, ни жары, ни холода, а в качестве экспертов в таких статьях выступают члены или руководители всевозможных экологических академий, фондов и союзов, а не специалисты-биотехнологи. Воистину, чем неправдоподобнее выдумка, тем быстрее в нее поверят. С надрывом сообщается о создании невозможных ранее форм жизни, например «рыбопомидора» (помидора с одним геном рыбы), — он почему-то особенно полюбился журналистам. Имеют ли подобные «страшилки» под собой научную основу? Попробуем разобраться.
Вот потому-то с легкой руки журналистов общественность узнала о «пище Франкенштейна», «продуктовом Чернобыле», «огородном джинне, который вырывается из бутылки». На полном серьезе печатают сообщения о трансгенных деревьях, подобно пушкинскому анчару выделяющих токсины и уничтожающих вокруг все живое; суперсорняках, не боящихся ни гербицидов, ни жары, ни холода, а в качестве экспертов в таких статьях выступают члены или руководители всевозможных экологических академий, фондов и союзов, а не специалисты-биотехнологи. Воистину, чем неправдоподобнее выдумка, тем быстрее в нее поверят. С надрывом сообщается о создании невозможных ранее форм жизни, например «рыбопомидора» (помидора с одним геном рыбы), — он почему-то особенно полюбился журналистам. Имеют ли подобные «страшилки» под собой научную основу? Попробуем разобраться.
Биотехнологов обвиняют в насилии над природой, так как они в отличие от обычных селекционеров пересаживают гены откуда угодно и куда угодно, что может привести к непредсказуемым последствиям. Некоторые непредсказуемые (вторичные) эффекты встраивания чужого гена в геном растения возможны. Но они в равной степени присущи и обычной селекции. И ГИР, и селекция переносят новый генетический материал, который может вызвать нарушение работы генов, их модификацию, выключение или активацию, что способно привести к выработке каких-то новых белков или изменению уровня существующих. Новые продукты жизнедеятельности клетки, в принципе, могут быть и токсичными, и аллергенными, и канцерогенными.
Некоторые непредсказуемые (вторичные) эффекты встраивания чужого гена в геном растения возможны. Но они в равной степени присущи и обычной селекции. И ГИР, и селекция переносят новый генетический материал, который может вызвать нарушение работы генов, их модификацию, выключение или активацию, что способно привести к выработке каких-то новых белков или изменению уровня существующих. Новые продукты жизнедеятельности клетки, в принципе, могут быть и токсичными, и аллергенными, и канцерогенными.
Примером появления непредсказуемых эффектов в обычной селекции служит история с гибридом кукурузы «Техас». В начале 70-х огромные посевные площади этой культуры в США были опустошены грибковым заболеванием. Выяснилось, что продукт гена, специфичного для данного гибрида, взаимодействовал с токсином гриба, что в результате приводило к развитию заболевания.
Итак, ГМР по возможным последствиям не опаснее обычной селекции. Мало того, иногда селекция приводит к гораздо более существенным нарушениям в геноме растения, чем направленная генетическая модификация. С 30-х годов ХХ века для целей селекции человек использует радиацию и химикалии, вызывая мутагенез. К настоящему времени известно около 2200 сортов различных культур, полученных таким способом. Очевидно, что в отличие от ГИР такое грубое вмешательство затрагивает не один ген и имеет непредсказуемые последствия.
С 30-х годов ХХ века для целей селекции человек использует радиацию и химикалии, вызывая мутагенез. К настоящему времени известно около 2200 сортов различных культур, полученных таким способом. Очевидно, что в отличие от ГИР такое грубое вмешательство затрагивает не один ген и имеет непредсказуемые последствия.
Опаснее ГИР может быть даже обычное скрещивание. К примеру, латинские буквы (Т, N, V, F) на упаковках семян томатов означают устойчивость к различным заболеваниям, полученную путем скрещивания с несъедобным для человека диким томатом. Помидоры, устойчивые к нематоде, содержат встроенный из генома его дикого сородича N сегмент (3,5 млн нуклеотидных пар), что составляет 0,3% от всей ДНК томата (для сравнения: ген устойчивости в трансгенных растениях имеет всего около 7 тысяч пар нуклеотидов). Таким образом, обычное скрещивание помимо нужного гена внедряет в растение несколько десятков лишних неизвестных генов. А гены из несъедобного растения вполне могут кодировать токсины, аллергены и другие вредные для человека вещества. И вот парадокс: томат, в который методами генной инженерии перенесли один-единственный известный и проверенный ген, будут тщательно изучать и регулировать его распространение, а томат, в который обычной селекцией перенесли десятки неизвестных генов, по международным правилам не требует никакого контроля и изучения.
И вот парадокс: томат, в который методами генной инженерии перенесли один-единственный известный и проверенный ген, будут тщательно изучать и регулировать его распространение, а томат, в который обычной селекцией перенесли десятки неизвестных генов, по международным правилам не требует никакого контроля и изучения.
ГИР не может быть «безопаснее», чем биология вообще, но и непредсказуемые эффекты для нее также не более вероятны. Человек в своем отборе часто использует признаки ненормальные и ненужные в природе для своих целей. Поэтому культурные растения способны существовать только с его помощью, а предоставленные самим себе дичают или подавляются сорняками. Так что не стоит обвинять создателей генетически модифицированных растений в насилии над природой. Разве создание нежизнеспособных в дикой природе организмов путем обычной селекции не насилие?
БЕЗОПАСНОСТЬ ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫХ ПРОДУКТОВ ПИТАНИЯЧеловек всегда употреблял в пищу растения и мясо животных, но у него не выросли ни листья, ни хвост — в организме все белковые молекулы и ДНК (гены) распадаются до структурных единиц, аминокислот и нуклеотидов, одинаковых у всего живого. Истории о том, что ГМ-продукты являются причиной раковых заболеваний, инфекций, СПИДа и др., всегда основаны на слухах: кто-то съел трансгенный продукт и после этого заболел. О латинской поговорке «Post hoc, nоn est propter hoc» (после этого — не значит из-за этого) и о притче, где некий врач на таких же основаниях сделал вывод: «Ветчина помогает от горячки портным, но не сапожникам» авторы таких изысканий, по-видимому, не слышали. Реальное же положение вещей таково: за почти двадцатилетнюю историю создания ГМР в научной литературе не было опубликовано ни одного достоверного сообщения о каком-либо негативном воздействии генетически модифицированных продуктов на организм человека.
Истории о том, что ГМ-продукты являются причиной раковых заболеваний, инфекций, СПИДа и др., всегда основаны на слухах: кто-то съел трансгенный продукт и после этого заболел. О латинской поговорке «Post hoc, nоn est propter hoc» (после этого — не значит из-за этого) и о притче, где некий врач на таких же основаниях сделал вывод: «Ветчина помогает от горячки портным, но не сапожникам» авторы таких изысканий, по-видимому, не слышали. Реальное же положение вещей таково: за почти двадцатилетнюю историю создания ГМР в научной литературе не было опубликовано ни одного достоверного сообщения о каком-либо негативном воздействии генетически модифицированных продуктов на организм человека.
Но, как мы уже говорили выше, принципиальная возможность появления веществ,
опасных для человека, при трансгенной модификации растений существует. Поэтому
самое главное опасение оппонентов ГМР — биологическая безопасность продуктов
питания. В качестве примера токсичности ГМ-пищи обычно приводят работу британского
ученого Арпада Пустаи, который занимался изучением токсичности картофеля с геном
лектина подснежника, встроенного для придания устойчивости к вредным насекомым. 10 августа 1998 года исследователь, выступая в телевизионной программе, заявил,
что у крыс, питавшихся трансгенным картофелем, наблюдались отклонения в росте,
а также подавление иммунной системы. Он также поведал телезрителям, что трансгенная
пища опасна для здоровья в принципе. Вскоре Пустаи был уволен: по версии руководства
— за «распространение заведомо ложной псевдонаучной информации», по версии противников
ГИР — под давлением биотехнологических компаний.
10 августа 1998 года исследователь, выступая в телевизионной программе, заявил,
что у крыс, питавшихся трансгенным картофелем, наблюдались отклонения в росте,
а также подавление иммунной системы. Он также поведал телезрителям, что трансгенная
пища опасна для здоровья в принципе. Вскоре Пустаи был уволен: по версии руководства
— за «распространение заведомо ложной псевдонаучной информации», по версии противников
ГИР — под давлением биотехнологических компаний.
В феврале 1999 года группа из 22 ученых выступила с меморандумом в поддержку Пустаи, а в июне Британское Королевское общество опубликовало заключение шести экспертов, проверявших результаты его исследований. В нем говорилось, что из-за недостатков в планировании и выполнении экспериментов просто невозможно определить причину наблюдаемых изменений, а влияние на иммунную систему статистически недостоверно. Но даже если бы результаты подкрепили сделанные заявления, то для обобщений об опасности всех генетически модифицированных продуктов не было никаких оснований.
Научное сообщество вопрошало, когда же Пустаи опубликует свои результаты, ведь выступление в телепрограмме — это одно, а статья в научном журнале — совсем другое: ей предшествуют две-три положительные рецензии специалистов в данной области. В октябре 1999 года на публикацию решился престижный британский медицинский журнал «Lancet». От громких заявлений в cтатье осталось только сообщение о некоторых изменениях в слизистой желудочно-кишечного тракта крыс. В том же номере в статье критиков указывалось, что подобные изменения вполне могли быть вызваны адаптацией к картофельной диете, нетипичной для этих животных, поскольку контроль состояния слизистой у крыс, питавшихся обычным образом, отсутствовал .
Помимо токсичности некоторые эксперты опасаются , что гены устойчивости к антибиотикам, используемые в технологии генетической модификации растений, могут перейти из ГМР в патогенные бактерии, которые приобретут устойчивость к препаратам, и лечение антибиотиками станет неэффективным. Но ведь все эти гены и выделены из генома бактерий, поскольку устойчивость к антибактериальным веществам широко распространена в природе. Устойчивость часто появляется в результате неправильного или избыточного использования антибиотиков. Тем не менее аспектом переноса генов устойчивости от растений в бактерии, живущие в желудочно-кишечном тракте человека, занимались ряд международных организаций, в том числе и Всемирная организация здравоохранения (ВОЗ). Они пришли к выводу, что такой перенос маловероятен из-за сложности соответствующих этапов. Пока случаи спонтанного переноса генов устойчивости из ГМР в клетки бактерий или млекопитающих неизвестны. В 2000 году эксперты Продовольственной организации ООН и ВОЗ сделали заключение, что гены устойчивости, используемые в настоящее время в ГИР, не представляют угрозы для терапевтического использования антибиотиков. Тем не менее для исключения даже гипотетической возможности переноса генов разработан ряд технологий, позволяющих обойтись без генов устойчивости к антибиотикам, удаляющих эти гены после трансформации или «запрещающих» этим генам «работать» в бактериях.
Но ведь все эти гены и выделены из генома бактерий, поскольку устойчивость к антибактериальным веществам широко распространена в природе. Устойчивость часто появляется в результате неправильного или избыточного использования антибиотиков. Тем не менее аспектом переноса генов устойчивости от растений в бактерии, живущие в желудочно-кишечном тракте человека, занимались ряд международных организаций, в том числе и Всемирная организация здравоохранения (ВОЗ). Они пришли к выводу, что такой перенос маловероятен из-за сложности соответствующих этапов. Пока случаи спонтанного переноса генов устойчивости из ГМР в клетки бактерий или млекопитающих неизвестны. В 2000 году эксперты Продовольственной организации ООН и ВОЗ сделали заключение, что гены устойчивости, используемые в настоящее время в ГИР, не представляют угрозы для терапевтического использования антибиотиков. Тем не менее для исключения даже гипотетической возможности переноса генов разработан ряд технологий, позволяющих обойтись без генов устойчивости к антибиотикам, удаляющих эти гены после трансформации или «запрещающих» этим генам «работать» в бактериях.
Возможная аллергенность ГМ-пищи также вызывает обеспокоенность ее противников. Пищевая аллергия — это побочная реакция на пищу, затрагивающая систему иммунитета, ею страдает до 8-10% детей и 1-2% взрослых. Теоретически каждый белок может действовать как аллерген. Наиболее распространенными аллергенами являются молоко, яйца, рыба, соя, арахис, орехи и пшеница. В качестве доказательств аллергенности ГМ-продуктов оппоненты ГИР обычно ссылаются на скандалы, связанные с трансгенной соей и кукурузой.
Соя, широко используемая в кормах для животных, как и остальные бобовые, относительно бедна незаменимой аминокислотой — метионином, поэтому для сбалансированного питания требуется добавлять в нее метионин или содержащий его белок. Попытки повысить содержание метионина путем обычной селекции успеха не имели, поэтому на помощь пришла генная инженерия. Семена бертолетии высокой («бразильские орехи»), по вкусу напоминающие кедровые орехи, содержат богатый метионином белок. Они широко используются в пищевой промышленности. К сожалению, подобно настоящим орехам, они способны вызывать аллергию. Ген из бертолетии перенесли в геном сои, и оказалось, что некоторые люди проявляют повышенную чувствительность к сое, модифицированной таким образом. Но в этой аллергической реакции не было ничего удивительного, поскольку те же самые люди реагировали и на бразильские орехи. Именно метионинсодержащий белок бразильского ореха является его основным аллергеном. И хотя эта соя предназначалась только для животных, производитель («Pioneer Hi-Bred»), опасаясь, что она может быть смешана с продовольственной, перестраховался и разработку трансгенной сои прекратил.
К сожалению, подобно настоящим орехам, они способны вызывать аллергию. Ген из бертолетии перенесли в геном сои, и оказалось, что некоторые люди проявляют повышенную чувствительность к сое, модифицированной таким образом. Но в этой аллергической реакции не было ничего удивительного, поскольку те же самые люди реагировали и на бразильские орехи. Именно метионинсодержащий белок бразильского ореха является его основным аллергеном. И хотя эта соя предназначалась только для животных, производитель («Pioneer Hi-Bred»), опасаясь, что она может быть смешана с продовольственной, перестраховался и разработку трансгенной сои прекратил.
Противники ГМ-пищи не преминули поднять по этому поводу шум: дескать, природа не простила насилия над собой и ответила созданием сильного аллергена. Позвольте, но при чем здесь генная инженерия? Этот белок является аллергеном сам по себе, и от добавления его в торт в составе орехов, переноса его гена методами генной инженерии или выделения в чистом виде и добавления в корм животным его аллергенность не изменится.
Скандал же, вызванный Bt-кукурузой, устойчивой к вредителям , случился в сентябре 2000 года. Тогда СМИ США сообщили о том, что трансгенный сорт кукурузы «Starlink», предназначенный для животных, случайно попал в продовольственное зерно и является сильным аллергеном. После этого сразу же посыпались сообщения о якобы наблюдавшихся аллергических реакциях у покупателей продуктов из кукурузы (до публикаций общественность молчала). Проверка ни у кого из жалобщиков аллергии на Вt-белок не обнаружила (кстати, и все ранее проведенные тесты на аллергенность этой кукурузы дали отрицатель ный результат). Но даже если бы жалобы подтвердились — эта кукуруза все равно изначально для людей не предназначалась. Биотехнологи не могут отвечать за недобросовестность компаний, использовавших корм для животных в пищу людям. Разве разработчиков производства технического спирта обвиняют в отравлениях, если его продавали под видом пищевого?
Другой аргумент: участившиеся случаи аллергии к сое вызваны якобы тем, что
все большая ее часть становится трансгенной. При этом забывается, что соя задолго
до появления ГМР считалась в Японии основным аллергеном (наряду с рисом), так
же как арахис в США, а треска в Скандинавии, что связано с широким употреблением
этих продуктов в пищу в данных странах. Все более широкое использование сои
в качестве добавок в самые различные пищевые продукты увеличивает количество
ее потребителей, а с ним растет и число людей, чувствительных к сое. Увеличение
потребления арахиса в мире наверняка приведет к увеличению числа аллергиков
к нему, но генная инженерия тут ни при чем.
При этом забывается, что соя задолго
до появления ГМР считалась в Японии основным аллергеном (наряду с рисом), так
же как арахис в США, а треска в Скандинавии, что связано с широким употреблением
этих продуктов в пищу в данных странах. Все более широкое использование сои
в качестве добавок в самые различные пищевые продукты увеличивает количество
ее потребителей, а с ним растет и число людей, чувствительных к сое. Увеличение
потребления арахиса в мире наверняка приведет к увеличению числа аллергиков
к нему, но генная инженерия тут ни при чем.
В принципе же, поскольку ГИР меняет белковый состав растений — вводит новые белки, модифицирует существующие или изменяет их количество, то аллергенность растения после генетической трансформации также может измениться. Именно поэтому ГМР тщательнейшим образом и в обязательном порядке проверяют на аллергенность.
Большинство ученых считают, что риск возникновения аллергии намного больше от новых продуктов питания, которые никто не проверяет на аллергенность, нежели от всесторонне изученных ГМ-продуктов. Поедая ГМ-пищу, вы потребляете один-два новых белка, а с новым продуктом вы получаете сотни новых белков. Появление киви в широкой продаже привело к появлению аллергиков на этот фрукт (аналогично сое). И уже потом было установлено, что плоды данного растения содержат несколько аллергенных белков. Если бы киви впервые поступило на рынок сегодня, по существующим правилам его могли бы рассматривать как новый продукт, тестировать на аллергенность, и, возможно, киви так никогда и не попало бы в продажу.
Поедая ГМ-пищу, вы потребляете один-два новых белка, а с новым продуктом вы получаете сотни новых белков. Появление киви в широкой продаже привело к появлению аллергиков на этот фрукт (аналогично сое). И уже потом было установлено, что плоды данного растения содержат несколько аллергенных белков. Если бы киви впервые поступило на рынок сегодня, по существующим правилам его могли бы рассматривать как новый продукт, тестировать на аллергенность, и, возможно, киви так никогда и не попало бы в продажу.
Перед производителями встал вопрос об оценке степени безопасности ГМ-продуктов питания. Вообще-то методы оценки безопасности пищи, которая представляет собой очень сложную смесь множества различных веществ, и ее тестирование на животных сложны и неоднозначны. Количество скармливаемой пищи ограничено эффектом насыщения, а сама она может не подходить тем или иным животным, вызывая ряд вредных эффектов (это, скорее всего, и произошло в опытах Пустаи). Поэтому безопасность большинства ныне существующих продуктов обосновывается не экспериментально, а по так называемой «истории безопасного использования». Сорта же, полученные обычной селекцией, оценивают всего лишь органолептически (на вкус и аромат), очень редко проводятся химические анализы — например, новые сорта картофеля проверяют на содержание соланина.
Сорта же, полученные обычной селекцией, оценивают всего лишь органолептически (на вкус и аромат), очень редко проводятся химические анализы — например, новые сорта картофеля проверяют на содержание соланина.
Сложность оценки риска потребовала нового подхода к оценке безопасности генетически модифицированных продуктов, и в 1993 году Организация экономического сотрудничества и развития (OECD) сформулировала концепцию «эквивалентности по существу» (substantial equivalence). Ее смысл — в определении не абсолютной безопасности генетически модифицированного продукта (на чем настаивают противники ГМ-пищи и что невозможно в принципе), а относительной — за исходный уровень безопасности принимается традиционный аналог ГМ-продукта. Вначале проводится идентификация различий, на которых затем сосредотачивается оценка безопасности.
Все ГМ-культуры, допущенные к использованию, были идентичны аналогам, за исключением одного-двух новых белков, соответствующих встроенным генам. Эти белки анализируют на токсичность и аллергенность, а также оценивают возможные вторичные эффекты. Концепция «эквивалентности по существу» принята во всем мире, в том числе и в странах ЕС. В ней указывается, что в качестве аналогов могут использоваться и ранее принятые ГМ-культуры. Она подвергается сильной критике со стороны экологических общественных организаций, обвиняющих ее в подгонке под требования производителей и заявляющих, что в ней не оцениваются долговременные эффекты употребления ГМ-продуктов. В ответ на это эксперты таких организаций, как ВОЗ, заявляют, что о возможных долговременных эффектах любой пищи известно крайне мало и что идентификация таковых очень сложна, если вообще возможна, на высоком фоне нежелательных эффектов обычной пищи. Действительно, что нам известно о долговременных эффектах употребления картофеля в России, где его едят всего 250 лет, или томатов, которые выращивают у нас не более 200 лет? А уж о бананах и прочих тропических фруктах, которые в широкой продаже у нас не более десятка лет, и упоминать не стоит.
Концепция «эквивалентности по существу» принята во всем мире, в том числе и в странах ЕС. В ней указывается, что в качестве аналогов могут использоваться и ранее принятые ГМ-культуры. Она подвергается сильной критике со стороны экологических общественных организаций, обвиняющих ее в подгонке под требования производителей и заявляющих, что в ней не оцениваются долговременные эффекты употребления ГМ-продуктов. В ответ на это эксперты таких организаций, как ВОЗ, заявляют, что о возможных долговременных эффектах любой пищи известно крайне мало и что идентификация таковых очень сложна, если вообще возможна, на высоком фоне нежелательных эффектов обычной пищи. Действительно, что нам известно о долговременных эффектах употребления картофеля в России, где его едят всего 250 лет, или томатов, которые выращивают у нас не более 200 лет? А уж о бананах и прочих тропических фруктах, которые в широкой продаже у нас не более десятка лет, и упоминать не стоит.
Много споров ведется и по маркировке генетически модифицированных продуктов. В США, где уже в 1999 году 60% всех продуктов в обычном супермаркете содержали
генетически модифицированные компоненты, маркировка — дело добровольное, а в
странах ЕС она обязательна, если их содержание в продукте превышает 1%. Вообще-то
маркировка не имеет отношения к безопасности: если продукт допущен к продаже,
то он уже признан безопасным. Настоящая ее цель — дать информацию для выбора
между товарами с различными характеристиками. Маркировка генетически модифицированных
продуктов, не отличающихся от обычных, — это уже излишне: никому ведь не интересно,
картофель каких сортов пошел на изготовление чипсов. Имеет смысл сообщать только
о содержании потенциально аллергенных белков (как про молочный и яичный белки
на упаковке обычного майонеза).
В США, где уже в 1999 году 60% всех продуктов в обычном супермаркете содержали
генетически модифицированные компоненты, маркировка — дело добровольное, а в
странах ЕС она обязательна, если их содержание в продукте превышает 1%. Вообще-то
маркировка не имеет отношения к безопасности: если продукт допущен к продаже,
то он уже признан безопасным. Настоящая ее цель — дать информацию для выбора
между товарами с различными характеристиками. Маркировка генетически модифицированных
продуктов, не отличающихся от обычных, — это уже излишне: никому ведь не интересно,
картофель каких сортов пошел на изготовление чипсов. Имеет смысл сообщать только
о содержании потенциально аллергенных белков (как про молочный и яичный белки
на упаковке обычного майонеза).
(Окончание следует.)
Трансгенные животные. Справка — РИА Новости, 30.06.2010
Все имеющиеся методы переноса генов (трансгеноз) пока еще не очень эффективны. Для получения одного трансгенного животного в среднем необходимы микроинъекции ДНК в 40 зигот мышей, 90 зигот козы, 100 зигот свиньи, 110 зигот овцы и в 1600 зигот коровы.
Для получения одного трансгенного животного в среднем необходимы микроинъекции ДНК в 40 зигот мышей, 90 зигот козы, 100 зигот свиньи, 110 зигот овцы и в 1600 зигот коровы.
При трансгенозе могут возникать неожиданные проблемы. Одна из первых работ по генетической транформации животных проводились путем встраивания генов гормона роста. Перенос гена гормона роста крысы мышам увеличивал рост мышей в 2 раза. Эксперименты по трансгенозу генов гормона роста быка кроликам также увенчались успехом. А вот аналогичные эксперименты по модификации крупного рогатого скота привели к увеличению прироста всего на 10 20%.
Технология создания трансгенных животных является одной из наиболее бурно развивающихся биотехнологий в последние 10 лет. Трансгенные животные широко используются как для решения большого числа теоретических задач, так и в практических целях для биомедицины и сельского хозяйства.
Уже получены трансгенные коровы и козы, в молоке которых содержится человеческий белок лактоферрин.
Американская корпорация Genzyme Transgenics проводит исследования с целью создания трансгенного крупного рогатого скота, содержащего в молоке человеческий альбумин. Альбумин используется в терапии для поддержания осмотического давления в крови. Genzyme Transgenics занимается разработкой аналогичных методов получения человеческого гормона роста и β интерферона.
В Англии созданы трансгенные овцы, молоко которых содержит фактор свертывания крови.
В России получены свиньи, несущие ген соматотропина. Они не отличались по темпам роста от нормальных животных, но изменение обмена веществ сказалось на содержании жира. Такие трансгенные свиньи были созданы для изучения цепочки биохимических превращений гормона, а побочным эффектом явилось укрепление иммунной системы.
Трансгенных животных получают и для целей ксенотрансплантации (пересадки органов человеку). Одним из излюбленных доноров органов являются свиньи, так как имеется анатомическое сходство органов и сходство иммунологических свойств. Реакции отторжения при трансплантации имеют сложный механизм. Одним из сигналов для атаки организма на чужой орган являются белки, локализованные на внешней поверхности мембраны. У трансгенных свиней эти белки заменены на человеческие.
Реакции отторжения при трансплантации имеют сложный механизм. Одним из сигналов для атаки организма на чужой орган являются белки, локализованные на внешней поверхности мембраны. У трансгенных свиней эти белки заменены на человеческие.
Существует множество трансгенных животных, моделирующих различные заболевания человека (рак, атеросклероз, ожирение и др.).
В практических целях трансгенные животные используются различными зарубежными фирмами как коммерческие биореакторы, обеспечивающие производство разнообразных медицинских препаратов (антибиотиков, факторов свертываемости крови и др.). Кроме того, перенос новых генов позволяет получать трансгенных животных, отличающихся повышенными продуктивными свойствами (например, усиление роста шерсти у овец, понижение содержания жировой ткани у свиней, изменение свойств молока) или устойчивостью к различным заболеваниям, вызываемым вирусами и другими патогенами. В настоящее время человечество уже использует множество продуктов, получаемых с помощью трансгенных животных: медицинские препараты, органы, пища.
Материал подготовлен на основе информации открытых источников
Что такое трансген?
Трансген — это участок генетического материала одного организма, который появляется в ДНК другого организма. В зависимости от ряда факторов, трансген может не проявлять экспрессию, может экспрессировать способом, отличным от наблюдаемого в исходном организме, или может экспрессироваться в новом организме точно так же, как это происходило в исходном организме. Ген идентифицируется как трансген, когда он секвенирован у одного вида, а затем идентифицирован у другого.
Некоторые трансгены встречаются в природе. Например, бактерии очень искусны в обмене генетическим материалом, даже между бактериальными видами, потому что это позволяет им быстро адаптироваться к изменяющимся условиям. Это одна из причин, почему лекарственная устойчивость вызывает беспокойство, потому что бактерии могут не только передавать лекарственную устойчивость членам своего вида, но и потенциально членам других видов.
В других случаях трансгены вводятся посредством генной инженерии. Генная инженерия используется для всего: от создания трансгенных мышей для лабораторных исследований до разработки новых культур, устойчивых к засухе. В этом случае интересующий ген идентифицируется и вставляется в геном целевого организма в надежде, что он будет экспрессироваться по желанию. Например, заголовки были сделаны в начале 21-го века, когда человек утверждал, что создал кролика, который светился в темноте, вставляя гены медузы в геном кролика.
Трансген может передаваться будущим поколениям, что иногда вызывает беспокойство у исследователей. Некоторые люди опасаются, что трансгенные организмы, полученные в лаборатории, могут ослабить дикие популяции тех же животных, или что введение трансгенов может иметь непредвиденные последствия, которые станут очевидными только тогда, когда станет слишком поздно. В ответ на это беспокойство иногда возникает стерильность в процессе генной инженерии, как, например, с трансгенными культурами, которые, как предполагается, не способны самостоятельно засевать.
Трансгены можно использовать и изучать различными способами. Трансген может быть использован, например, для такой цели, как введение человеческой ДНК лабораторным животным для изучения патологии человека без экспериментов на людях. Исследование экспрессии генов или их отсутствия также может быть выполнено с использованием трансгенов и трансгенных организмов. Людям может быть интересно, например, о генах, которые кажутся неактивными у некоторых видов животных, задаваясь вопросом, являются ли эти гены реликтами предков или могут ли они быть индуцированы для экспрессии.
ДРУГИЕ ЯЗЫКИ
Слово ТРАНСГЕННЫЙ — Что такое ТРАНСГЕННЫЙ?
Слово состоит из 11 букв: первая т, вторая р, третья а, четвёртая н, пятая с, шестая г, седьмая е, восьмая н, девятая н, десятая ы, последняя й,
Слово трансгенный английскими буквами(транслитом) — transgennyi
Значения слова трансгенный.
 Что такое трансгенный?
Что такое трансгенный?Трансген
Трансген — чужеродный фрагмент ДНК, переносимый при помощи генно-инженерных манипуляций в геном определённого организма. Трансген может быть выделен из биологического объекта или синтезирован искусственно.
ru.wikipedia.org
Трансгенная соя
Трансгенная соя — соя, полученная с применением генной инженерии (см. генетически модифицированный организм). На сегодня на рынке присутствует только один вид трансгенной сои, устойчивой к гербициду Раунда́п.
ru.wikipedia.org
Трансгенный организм
Трансге́нный органи́зм — живой организм, в геном которого искусственно введен ген другого организма. Ген вводится в геном хозяина в форме так называемой «гентической конструкции» — последовательности ДНК, несущей участок, кодирующий белок.
ru.wikipedia.org..
Трансгенные организмы
ТРАНСГЕННЫЕ ОРГАНИЗМЫ — по определению ФЗ «О государственном регулировании в области генно-инженерной деятельности» от 5 июня 1996 г. «животные, растения, микроорганизмы, вирусы…
Словарь юридических терминов. — 2000
Трансгенные организмы — животные, растения, микроорганизмы, вирусы, генетическая программа которых изменена с использованием методов генной инженерии.
glossary.ru
Трансгенные организмы — животные, растения, микроорганизмы, вирусы, генетическая программа которых изменена с применением методов генной инженерии. Федеральный закон от 05.07.96 N 86-ФЗ, ст.2.
Словарь юридических понятий. — 1997
Трансгенный (transgenic)
Трансгенный (transgenic) Трансгенный (transgenic) — Организм, геном которого (или геномы отдельных его клеток или тканей) включает чужеродный генетический материал, внесенный с использованием методов генной инженерии.
www.xumuk.ru
Русский язык
Трансге́нный.
Словарь ударений. — 2000
- трансбордер
- трансвааль
- трансвертер
- трансгенный
- трансграничный
- трансгрессивный
- трансгрессия
Ошибка 404. Страница не найдена!
ИЗМЕНЕНИЯ ПОДАЧИ ЗАЯВЛЕНИЙ НА СДАЧУ ОГЭ В 2021
Дубненские выпускники 9-х классов смогут подать заявление на сдачу основного государственного экзамена (далее-ОГЭ) дистанционно. Подробнее>>
ПЛАН по устранению недостатков, выявленных в ходе независимой оценки качества условий оказания услуг МБОУ «Гуманитарно-эстетической гимназии №11. г.Дубны Московской области на 2020 год». pdf
pdf
Уважаемые учащиеся и родители!
Уважаемые родители!
В соответствии с Приказом Министерства просвещения Российской Федерации от 02.09.2020 № 458 «Об утверждении Порядка приема на обучение по образовательным программам начального общего, основного общего и среднего общего образования» информируем Вас об изменении сроков приема заявлений в первый класс на 2021-2022 учебный год.
Уважаемые родители!
Информируем вас о том, что записаться на «Родительский контроль» — проект по оценке качества питания в школах — в Подмосковье теперь можно в режиме онлайн. Сделать это можно на Школьном портале региона. Регистрация проходит быстро — вся процедура займет не более трех минут.
— Нужно перейти во вкладку «Родительская»;
— Перейти в раздел «Школьное питание»;
— Выбрать желаемую дату и время;
— Нажать кнопку «Записаться».
Школа автоматически получит заявку и в назначенное время родителя будет ожидать классный руководитель или ответственный за питание.
Проект «Билет в будущее»
Билет в будущее» — это проект ранней профессиональной ориентации школьников 6−11 классов.
Кампания проекта проходит с июля по ноябрь 2020 года. Родителю и ребенку нужно пройти регистрацию на Платформе проекта по адресу https://bilet.worldskills.ru/, у каждого будет свой личный кабинет, в котором будут отражаться результаты участия.
Инструкция для регистрации .pdf
Подготовка к егэ
Приказ №164 от 29.05.2020г. «Об организации подготовки к ЕГЭ в режиме онлайн в 2020г».pdf
График консультаций ЕГЭ в режиме онлайн. pdf
Приказ №166 от 29.05.2020 «О внесении изменений в приказ №142 от 29.04.2020 «Об организации сотрудников гимназии №11 с 01.06.2020 по 14.06.2020г.» .pdf
внимание
Приказ №151а от 12. 05.2020 «О внесении изменений в приказ №142 от 29.04.2020 «Об организации сотрудников гимназии №11 с 06.04.2020 по 31.05.2020» .pdf
05.2020 «О внесении изменений в приказ №142 от 29.04.2020 «Об организации сотрудников гимназии №11 с 06.04.2020 по 31.05.2020» .pdf
Приказ №142 от 29.04.2020 «О внесении изменений в приказ №136 от 06.04.2020 «Об организации сотрудников гимназии №11 с 06.04.2020 по 30.04.2020» .pdf
Северное инспекторское отделение Центра ГИМС ГУ МЧС России по Московской области информирует
Сейчас на территории Подмосковья действует режим самоизоляции и покидать дома без острой необходимости запрещается, а прогулки у воды без присмотра взрослых могут стоить жизни. К сожалению, не все родители объясняют своим детям, что же означает этот режим, и к каким последствиям могут привести прогулки.
Самоизоляция – это комплекс ограничительных мер для населения, которые вводит правительство на определенный срок для борьбы с распространением опасного заболевания.
Граждан просят соблюдать режим: не выходить на улицу без острой необходимости, ограничить контакты с другими людьми и соблюдать все рекомендации по профилактике вирусных заболеваний, предложенные медицинским сообществом.
Уважаемые родители и дети просим Вас не пользоваться береговой зоной водоемов и не нарушать режим самоизоляции.
Берегите себя и своих близких!!!
Приказ №136 от 06.04.2020 «Об организации работы сотрудников гимназии №11 с 06.04.2020г. по 30.04.2020г » .pdf
Приказ №134 от 03.04.2020 «О переходе на обучение с использованием электронного обучения и дистанционных образовательных программ» .pdf
Регламент организации дистанционного обучения в Гимназии №11
Дорогие участники образовательного процесса, учащиеся, учителя, родители! Познакомьтесь с регламентом организации дистанционного обучения .pdf
Изменения в Постановлении Губернатора Московской области
Уважаемые родители и ученики! Согласно постановлению Губернатора Московской области №171-ПГ от 02.04.2020 образовательный процесс в Гимназии №11 с 06. 04.2020 по 30.04.2020 будет осуществляться с использованием электронного обучения и дистанционных образовательных технологий .pdf
04.2020 по 30.04.2020 будет осуществляться с использованием электронного обучения и дистанционных образовательных технологий .pdf
О режиме повышенной готовности в гимназии №11
20 марта на сайте гимназии опубликован приказ №122 » О введении режима повышенной готовности в гимназии №11″ .pdf
меры профилактики гриппа и ОРВИ
Уважаемые родители!
Ежегодно в конце зимы и начале весны увеличивается число заболевших гриппом и ОРВИ. Давайте отнесемся к здоровью наших детей в этот период с особым вниманием. Узнать более подробно о мерах профилактики данных заболеваний:
https://www.rospotrebnadzor.ru/about/info/news_time/news_details.php?ELEMENT_ID=13566
УВАЖАЕМЫЕ РОДИТЕЛИ! ПРИМИТЕ УЧАСТИЕ В ОПРОСЕ
Родителям будущих первоклассников!
График приема родителей: (приказ.pdf)
1 февраля 2020г. — с 09.00 до 17.00 (обед 13.00-14.00)
2 февраля 2020г. — с 09.00 до 17.00 (обед 13.00-14.00)
— с 09.00 до 17.00 (обед 13.00-14.00)
с 03.02.2020 — 30.06.2020г. с с 09.00 до 18.00 (обед 13.00-14.00) с понедельника по пятницу
С 1 февраля 2020 года начинается прием заявлений от родителей (законных представителей) на зачисление детей в 1 класс 2020 – 2021 учебного года в электронном виде для граждан, проживающих на закрепленной территории, посредством Портала государственных и муниципальных услуг Московской области https://uslugi.mosreg.ru/.
Подробнее по ссылке>>
Учитель шахмат
Департамент государственной политики в сфере общего образования Министерства Просвещения РФ информирует о проведении конкурса «Учитель шахмат», организатором которого является Общероссийская общественная организация «Федерация шахмат России». Заявки на участие в конкурсе принимаются до 15 апреля 2019 года.
Показать/скрытьФорму заявки можно скачать по ссылке. Конкурсные материалы принимаются с 16 апреля до 30 июня 2019 года. Форму для прикрепления конкурсных материалов можно скачать здесь. Контактное лицо: руководитель проекта «Шахматный всеобуч России» Костьев Александр Николаевич, тел. 8(968)732-00-74, адрес электронной почты: [email protected].
Форму для прикрепления конкурсных материалов можно скачать здесь. Контактное лицо: руководитель проекта «Шахматный всеобуч России» Костьев Александр Николаевич, тел. 8(968)732-00-74, адрес электронной почты: [email protected].
Урок мужества
1 марта 2019 г. во всех классах школы пройдет Урок мужества. В этот день будет проходить торжественная церемония награждения детей-лауреатов Всероссийской общественной инициативы «Горячее сердце».
Показать/скрытьЦелью такого урока является формирование у школьников готовности к общественной полезной деятельности, преодолению сложных ситуаций в семье или ограничений здоровья.
Лауреатами «Горячего сердца» являются дети, которые спасли людей при пожарах, помогли оказавшимся в беде или в сложной ситуации, участвовали в борьбе с распространением наркотиков, а также добились успеха в различных видах деятельности, несмотря на ограничения здоровья.
Методические рекомендации
Ребята и их родители!
Приглашаем вас принять участие в увлекательных конкурсах! Зарегистрируйтесь на сайте https://www. prav-pit.ru/, если есть вопросы, обращайтесь за помощью к координатору конкурса в гимназии №11социальному педагогу Волковой Елене Ивановне.
prav-pit.ru/, если есть вопросы, обращайтесь за помощью к координатору конкурса в гимназии №11социальному педагогу Волковой Елене Ивановне.
01.11.2018 – 15.06.2019
Конкурс семейной фотографии. Участники конкурса должны подготовить семейный фотоплакат, демонстрирующий важность здорового образа жизни.
15.10.2018 – 30.08.2019
Фотоконкурс “Воспитываем здоровых и счастливых”. Участвуйте конкурсе и размещайте свои фотографии, рассказывающие о том, как в вашей семье воспитывают здоровых и счастливых!
Авторы фотографий, за которых проголосует больше всего посетителей сайта, получат главный приз — 3 дневную экскурсионную поездку в Москву.
ЕСИА Условия успешной авторизации на Школьном портале через ЕСИА (только для пользователей старше 14 лет)
1.Наличие Подтверждённой учётной записиЕСИА (подробно о том, как и где подтвердить учётную запись ЕСИА, рассказано здесь)
2. Наличие учётной записи в системе «Школьный портал»
Наличие учётной записи в системе «Школьный портал»
3.Совпадение ФИО и СНИЛС в учётных записях ЕСИА и системы «Школьный портал»
ВНИМАНИЕ! В случае отсутствия СНИЛС в учетной записи необходимо выполнить связывание своих учетных записей вручную. Как это сделать: https://helpschool.mosreg.ru/hc/ru/articles/360001467547
Уважаемые родители!Информацию о приеме в кружки и секции дополнительного образования на 2018/2019 уч.г. можно посмотреть в разделе Родителям
Уважаемые учащиеся!
Предлагаем вам ознакомиться с материалами и принять участие в VIII Всероссийском конкурсе социальной рекламы «Новый взгляд». Подробнее…Уважаемые учащиеся и родители!
Министерство здравоохранения Московской области в рамках подготовки к Всемирному Дню сердца предлагает ознакомиться с видео-роликом о первых признаках инсульта «УДАР», а также на сайте службы медицинской профилактики Московской области пройти анкетирование и ознакомиться с полезной информацией о факторах риска развития инсульта.
Transgene — обзор | Темы ScienceDirect
Экспрессия трансгенов
Трансгены, которые вводятся с помощью пронуклеарной микроинъекции, предназначены для функционирования после вставки в различные участки генома хозяина. Экспрессия такого трансгена зависит от нескольких факторов, включая регуляторные элементы (т.е. последовательности, которые регулируют транскрипцию, процессинг РНК и трансляцию), включенные в трансген, сайт встраивания в геном хозяина и количество копий трансген.Некоторые трансгены состоят из сегмента геномной ДНК, включающего ген (экзоны и интроны) вместе с определенной частью естественной 5′- и 3′-фланкирующей ДНК. Экспрессия такого «геномного» трансгена зависит от того, включает ли сегмент ДНК все регуляторные элементы, которые обычно регулируют экспрессию гена. У млекопитающих регуляторные элементы иногда располагаются на расстоянии> 100 т.п.н. от гена, поэтому может потребоваться перенос очень большого сегмента геномной ДНК для обеспечения правильной экспрессии. Чаще трансген состоит из клона кДНК (обеспечивающего кодирующие последовательности), соединенного с гетерологичным промотором, энхансером (ами), интроном и сигналами полиаденилирования для создания искусственного «трансгена кДНК». Этот подход можно использовать для экспрессии практически любого гена в любом типе клеток или ткани, для которых были определены соответствующие регуляторные последовательности, хотя уровень экспрессии может быть ниже, чем полученный с геномным трансгеном. Характер экспрессии, продиктованный регуляторными последовательностями в геномном трансгене или трансгене кДНК, может быть отменен влиянием соседней ДНК хозяина, как следствие случайной вставки в геном.Такие «эффекты положения» могут заглушить трансген во всех клетках или во фракции клеток или изменить его уровень или паттерн экспрессии. В целом существует положительная корреляция между числом копий трансгена и уровнем экспрессии, хотя эта связь может быть замаскирована эффектами положения.
Чаще трансген состоит из клона кДНК (обеспечивающего кодирующие последовательности), соединенного с гетерологичным промотором, энхансером (ами), интроном и сигналами полиаденилирования для создания искусственного «трансгена кДНК». Этот подход можно использовать для экспрессии практически любого гена в любом типе клеток или ткани, для которых были определены соответствующие регуляторные последовательности, хотя уровень экспрессии может быть ниже, чем полученный с геномным трансгеном. Характер экспрессии, продиктованный регуляторными последовательностями в геномном трансгене или трансгене кДНК, может быть отменен влиянием соседней ДНК хозяина, как следствие случайной вставки в геном.Такие «эффекты положения» могут заглушить трансген во всех клетках или во фракции клеток или изменить его уровень или паттерн экспрессии. В целом существует положительная корреляция между числом копий трансгена и уровнем экспрессии, хотя эта связь может быть замаскирована эффектами положения.
В дополнение к регуляторным элементам, которые могут управлять экспрессией в определенных типах клеток, тканях или временных моделях, в трансген могут быть включены последовательности, чтобы сделать его экспрессию зависимой от введения лекарства, изменения температуры или других экспериментальных манипуляций. Например, промоторы, которые можно регулировать введением антибиотиков, гормонов или ионов металлов, широко используются для включения и выключения трансгенов по желанию во время развития эмбриона или в течение жизни взрослого животного.
Например, промоторы, которые можно регулировать введением антибиотиков, гормонов или ионов металлов, широко используются для включения и выключения трансгенов по желанию во время развития эмбриона или в течение жизни взрослого животного.
За счет использования ES-клеток (и, возможно, посредством переноса ядра из соматических клеток) проблему позиционных эффектов можно обойти, нацелив желаемую кодирующую последовательность на конкретный локус, где она попадает под контроль естественных регуляторных механизмов в этот локус.Например, для экспрессии чужеродного белка в эритроцитах соответствующие кодирующие последовательности могут быть слиты с регуляторными элементами гена β-глобина (кодирующего β-цепь гемоглобина) и введены в случайные участки генома мыши с помощью микроинъекции пронуклеусов. . Альтернативно, кодирующие последовательности могут быть вставлены посредством гомологичной рекомбинации для замены кодирующих последовательностей гена β-глобина мыши в ES-клетках, которые затем могут быть использованы для получения химерных мышей зародышевой линии.
Transgene — обзор | Темы ScienceDirect
Экспрессия трансгенов
Трансгены, которые вводятся с помощью пронуклеарной микроинъекции, предназначены для функционирования после вставки в различные участки генома хозяина.Экспрессия такого трансгена зависит от нескольких факторов, включая регуляторные элементы (т.е. последовательности, которые регулируют транскрипцию, процессинг РНК и трансляцию), включенные в трансген, сайт встраивания в геном хозяина и количество копий трансген. Некоторые трансгены состоят из сегмента геномной ДНК, включающего ген (экзоны и интроны) вместе с определенной частью естественной 5′- и 3′-фланкирующей ДНК. Экспрессия такого «геномного» трансгена зависит от того, включает ли сегмент ДНК все регуляторные элементы, которые обычно регулируют экспрессию гена.У млекопитающих регуляторные элементы иногда располагаются на расстоянии> 100 т.п.н. от гена, поэтому может потребоваться перенос очень большого сегмента геномной ДНК для обеспечения правильной экспрессии. Чаще трансген состоит из клона кДНК (обеспечивающего кодирующие последовательности), соединенного с гетерологичным промотором, энхансером (ами), интроном и сигналами полиаденилирования для создания искусственного «трансгена кДНК». Этот подход можно использовать для экспрессии практически любого гена в любом типе клеток или ткани, для которых были определены соответствующие регуляторные последовательности, хотя уровень экспрессии может быть ниже, чем полученный с геномным трансгеном.Характер экспрессии, продиктованный регуляторными последовательностями в геномном трансгене или трансгене кДНК, может быть отменен влиянием соседней ДНК хозяина, как следствие случайной вставки в геном. Такие «эффекты положения» могут заглушить трансген во всех клетках или во фракции клеток или изменить его уровень или паттерн экспрессии. В целом существует положительная корреляция между числом копий трансгена и уровнем экспрессии, хотя эта связь может быть замаскирована эффектами положения.
Чаще трансген состоит из клона кДНК (обеспечивающего кодирующие последовательности), соединенного с гетерологичным промотором, энхансером (ами), интроном и сигналами полиаденилирования для создания искусственного «трансгена кДНК». Этот подход можно использовать для экспрессии практически любого гена в любом типе клеток или ткани, для которых были определены соответствующие регуляторные последовательности, хотя уровень экспрессии может быть ниже, чем полученный с геномным трансгеном.Характер экспрессии, продиктованный регуляторными последовательностями в геномном трансгене или трансгене кДНК, может быть отменен влиянием соседней ДНК хозяина, как следствие случайной вставки в геном. Такие «эффекты положения» могут заглушить трансген во всех клетках или во фракции клеток или изменить его уровень или паттерн экспрессии. В целом существует положительная корреляция между числом копий трансгена и уровнем экспрессии, хотя эта связь может быть замаскирована эффектами положения.
В дополнение к регуляторным элементам, которые могут управлять экспрессией в определенных типах клеток, тканях или временных моделях, в трансген могут быть включены последовательности, чтобы сделать его экспрессию зависимой от введения лекарства, изменения температуры или других экспериментальных манипуляций. Например, промоторы, которые можно регулировать введением антибиотиков, гормонов или ионов металлов, широко используются для включения и выключения трансгенов по желанию во время развития эмбриона или в течение жизни взрослого животного.
Например, промоторы, которые можно регулировать введением антибиотиков, гормонов или ионов металлов, широко используются для включения и выключения трансгенов по желанию во время развития эмбриона или в течение жизни взрослого животного.
За счет использования ES-клеток (и, возможно, посредством переноса ядра из соматических клеток) проблему позиционных эффектов можно обойти, нацелив желаемую кодирующую последовательность на конкретный локус, где она попадает под контроль естественных регуляторных механизмов в этот локус.Например, для экспрессии чужеродного белка в эритроцитах соответствующие кодирующие последовательности могут быть слиты с регуляторными элементами гена β-глобина (кодирующего β-цепь гемоглобина) и введены в случайные участки генома мыши с помощью микроинъекции пронуклеусов. . Альтернативно, кодирующие последовательности могут быть вставлены посредством гомологичной рекомбинации для замены кодирующих последовательностей гена β-глобина мыши в ES-клетках, которые затем могут быть использованы для получения химерных мышей зародышевой линии.
История и роль в создании моделей животных
15 мая 2018 г. | гениальный | Трансгенный
Что такое трансген и каково его основное назначение?
При рассмотрении вопроса «что такое трансген и зачем он нужен» большинство ученых указали бы на большое количество генетических исследований, которые используются сегодня.Трансгены — неотъемлемая часть современных генетических манипуляций, но что они собой представляют? Каковы их основная основная цель и преимущества, и что заставляет их играть такую ключевую роль в разработке гуманизированных моделей мышей и различных методов генетической манипуляции, предназначенных для борьбы с конкретными заболеваниями?
Что такое трансгены?
Прежде чем идти дальше: что такое трансген? Концепция трансгена широко понималась более 100 лет, когда в 20-м веке появились генетические исследования.Со временем технологии развивались, и трансгены стали широко использоваться в конце 1970-х — начале 80-х годов. Трансгены — это части генетического материала, которые используются для модификации генома определенного организма. Изменение фенотипа организма также возможно за счет использования трансгенов. Для правильного функционирования трансгенам требуется несколько ключевых компонентов. Промотор представляет собой регуляторную последовательность, которая определяет, где и когда трансген будет активирован, в то время как экзон отвечает за последовательность, кодирующую белок, и за стоп-последовательность.Третий элемент — бактериальная плазмида, которая используется для доставки этих компонентов в геном хозяина.
Трансгены — это части генетического материала, которые используются для модификации генома определенного организма. Изменение фенотипа организма также возможно за счет использования трансгенов. Для правильного функционирования трансгенам требуется несколько ключевых компонентов. Промотор представляет собой регуляторную последовательность, которая определяет, где и когда трансген будет активирован, в то время как экзон отвечает за последовательность, кодирующую белок, и за стоп-последовательность.Третий элемент — бактериальная плазмида, которая используется для доставки этих компонентов в геном хозяина.
«Проект был очень хорошо управляем… фактически, использование iTL подтвердило мое решение не пытаться делать это в моей лаборатории. Это было бы катастрофой … (Мой менеджер проекта) был очень любезен, всегда возвращался к нам вовремя и объяснял каждый шаг проекта. Я был бы рад служить в качестве ориентира для iTL и ее сотрудников ».
Клаус Фиммель, доктор медицины
Медицинский центр Университета Лойолы
Почему трансгены так важны?
Когда вы спрашиваете «что такое трансген», вы также должны спросить себя, почему трансгены вообще были разработаны? Трансгенные организмы играют важную роль в экспрессии различных генов, что может сделать их уязвимыми для определенных расстройств или состояний, которые исследователи стремятся изучить. Ценные исследования, полученные при разработке гуманизированных трансгенных мышей, например, были использованы для разработки новых методов лечения рака и других, не менее изнурительных заболеваний. Достижения в молекулярной биологии позволяют разрабатывать новые модели, помогая ученым более внимательно изучать геном человека и такие состояния, как старение, диабет, бесплодие и иммунный ответ.
Ценные исследования, полученные при разработке гуманизированных трансгенных мышей, например, были использованы для разработки новых методов лечения рака и других, не менее изнурительных заболеваний. Достижения в молекулярной биологии позволяют разрабатывать новые модели, помогая ученым более внимательно изучать геном человека и такие состояния, как старение, диабет, бесплодие и иммунный ответ.
Первые трансгенные организмы
Первый трансген, который был получен в контролируемых условиях с помощью специфических методов генетической манипуляции, был в 1974 году.Затем гены Staphylococcus aureus были успешно введены в e. coli. Первым эукариотическим организмом, который был использован в эксперименте по переносу генов, были дрожжи в 1978 году. После дрожжей первая модель трансгенной мыши была разработана всего год спустя. Во время первых пробных экспериментов ДНК переносилась непосредственно в клетки-мишени с помощью микроинъекции.
Современные примеры использования трансгена
Что такое трансген и как он используется сегодня? Хотя существует множество примеров, возможно, наиболее значимым является использование трансгенов в растениях и продуктах питания. Кукуруза, хлопок и рапс — это лишь некоторые из растений, которые были генетически модифицированы с целью максимального увеличения урожайности и здоровья сельскохозяйственных культур. Новые мышиные модели также разрабатываются на регулярной основе, онкомыши — это совершенно новый генетически модифицированный вид мышей, разработанный для изучения рака. Рассматривая вопрос «что такое трансген и чего нам следует ожидать в будущем», исследователи также указывают на потенциальные применения, такие как ксенотрансплантация органов, разработка продуктов на основе искусственного белка и лекарство от генетических нарушений, связанных с фертильностью.
Кукуруза, хлопок и рапс — это лишь некоторые из растений, которые были генетически модифицированы с целью максимального увеличения урожайности и здоровья сельскохозяйственных культур. Новые мышиные модели также разрабатываются на регулярной основе, онкомыши — это совершенно новый генетически модифицированный вид мышей, разработанный для изучения рака. Рассматривая вопрос «что такое трансген и чего нам следует ожидать в будущем», исследователи также указывают на потенциальные применения, такие как ксенотрансплантация органов, разработка продуктов на основе искусственного белка и лекарство от генетических нарушений, связанных с фертильностью.
Поделись этим: Facebook Твиттер LinkedIn
трансгенных организмов — Genetics Generation
Трансгенные организмы
Изображение любезно предоставлено Национальным институтом исследования генома человека Современные генетические технологии могут быть использованы для модификации геномов живых организмов. Этот процесс также известен как «генная инженерия». Гены одного вида могут быть модифицированы или гены могут быть трансплантированы от одного вида к другому. Генная инженерия стала возможной благодаря технологии рекомбинантной ДНК.Организмы с измененными геномами известны как трансгенные. Большинство трансгенных организмов создается в лаборатории для исследовательских целей. Например, «нокаутные» мыши — это трансгенные мыши, у которых отключен конкретный представляющий интерес ген. Изучая эффекты отсутствующего гена, исследователи могут лучше понять нормальную функцию гена.
Этот процесс также известен как «генная инженерия». Гены одного вида могут быть модифицированы или гены могут быть трансплантированы от одного вида к другому. Генная инженерия стала возможной благодаря технологии рекомбинантной ДНК.Организмы с измененными геномами известны как трансгенные. Большинство трансгенных организмов создается в лаборатории для исследовательских целей. Например, «нокаутные» мыши — это трансгенные мыши, у которых отключен конкретный представляющий интерес ген. Изучая эффекты отсутствующего гена, исследователи могут лучше понять нормальную функцию гена.
Трансгенные организмы также были разработаны для коммерческих целей. Возможно, наиболее известными примерами являются продовольственные культуры, такие как соя и кукуруза, которые были генетически модифицированы для обеспечения устойчивости к вредителям и гербицидам.Эти культуры широко известны как «ГМО» (генетически модифицированные организмы). Вот еще несколько примеров трансгенных организмов, имеющих коммерческую ценность:
* Золотой рис: модифицированный рис, производящий бета-каротин, предшественник витамина А. Дефицит витамина А является проблемой общественного здравоохранения для миллионов людей во всем мире,
Дефицит витамина А является проблемой общественного здравоохранения для миллионов людей во всем мире,
особенно в Африке и Юго-Восточной Азии. Золотой рис все еще ожидает одобрения регулирующих органов.
* Козы, которые производят важные белки в своем молоке: козы, модифицированные для производства одобренного FDA-
человеческого антитромбина ( ATryn ), который используется для лечения редкого нарушения свертывания крови
у людей.Козы также были генетически модифицированы для производства шелка паука ,
, одного из самых прочных материалов, известных человеку, в их молоке. Предлагаемые варианты использования этого рекомбинантного паучьего шелка
варьируются от искусственных сухожилий до пуленепробиваемых жилетов.
* Бананы, производящие вакцину: бананы, полученные с помощью генной инженерии, содержащие вакцину. Бананы являются простым средством доставки вакцины (особенно детям) без необходимости в медицинском работнике, обученном делать прививки. Пищевые вакцины все еще находятся в разработке.
Пищевые вакцины все еще находятся в разработке.
* Микроорганизмы, продуцирующие химозин: дрожжи, грибы или бактерии, модифицированные для производства фермента.
химозин, который расщепляет молоко для производства сыра. Традиционно сычужный фермент (содержащийся в желудках коров) используется для свертывания сыра. Но когда спрос на твердые сыры превысил количество доступного сычужного фермента, был разработан рекомбинантный химозин, который широко используется сегодня.
* Картофель с низким содержанием акриламида : Компания J.R. Simplot разработала штамм трансгенного картофеля, который модифицирован таким образом, чтобы противостоять синякам и потемнению при разрезании.Они также производят меньше аминокислоты аспарагина. Аспарагин способствует образованию акриламида, известного нейротоксина и, вероятно, канцерогена, когда картофель готовится при высоких температурах. Это означает, что картофель фри будет более здоровым!
НАЖМИТЕ ЗДЕСЬ , чтобы узнать больше о технологии рекомбинантной ДНК
8.
 8: Трансгенные организмы — Биология LibreTexts
8: Трансгенные организмы — Биология LibreTextsОбщие принципы трансгенеза
Трансгенные организмы содержат чужеродную ДНК, которая была интродуцирована с помощью биотехнологии.Чужеродная ДНК (трансген ) определяется здесь как ДНК другого вида или рекомбинантная ДНК того же вида, с которой манипулировали в лаборатории, а затем повторно вводили. Термины трансгенный организм и генетически модифицированный организм ( GMO ) обычно являются синонимами. Процесс создания трансгенных организмов или клеток, которые станут целыми организмами с постоянным изменением их зародышевой линии, был назван либо трансформацией , либо трансфекцией .(К сожалению, оба слова имеют разные значения. Трансформация также относится к процессу превращения клетки млекопитающего в раковую, в то время как трансфекция также относится к процессу введения ДНК в клетки в культуре, будь то бактериальные или эукариотические, для временного использования, а не изменения зародышевой линии. .) Трансгенные организмы — важные инструменты исследования, которые часто используются при изучении функции гена. Трансгенез также связан с медицинской практикой генной терапии, при которой ДНК переносится в клетки пациента для лечения болезни.Трансгенные организмы широко распространены в сельском хозяйстве. Примерно 90% рапса, хлопка, кукурузы, сои и сахарной свеклы, выращиваемых в Северной Америке, являются трансгенными. Никакие другие трансгенные животные или сельскохозяйственные культуры (за исключением некоторых видов кабачков, папайи и люцерны) в настоящее время не выращиваются в Северной Америке.
.) Трансгенные организмы — важные инструменты исследования, которые часто используются при изучении функции гена. Трансгенез также связан с медицинской практикой генной терапии, при которой ДНК переносится в клетки пациента для лечения болезни.Трансгенные организмы широко распространены в сельском хозяйстве. Примерно 90% рапса, хлопка, кукурузы, сои и сахарной свеклы, выращиваемых в Северной Америке, являются трансгенными. Никакие другие трансгенные животные или сельскохозяйственные культуры (за исключением некоторых видов кабачков, папайи и люцерны) в настоящее время не выращиваются в Северной Америке.
Чтобы создать трансгенную клетку, ДНК необходимо сначала перенести через клеточную мембрану (и, если она есть, через клеточную стенку), не разрушая клетку. В некоторых случаях голая ДНК (имеется в виду плазмида или линейная ДНК, которая не связана с каким-либо типом носителя ) может быть перенесена в клетку путем добавления ДНК в среду и временного увеличения пористости мембраны, например, путем Электропорация . При работе с более крупными клетками голую ДНК можно также микроинъектировать в клетку с помощью специальной иглы. Другие методы используют векторов для транспортировки ДНК через мембрану. Обратите внимание, что слово «вектор», используемое здесь, относится к любому типу носителя, а не только к плазмидным векторам. Векторы для трансформации / трансфекции включают везикул , состоящих из липидов или других полимеров, окружающих ДНК; различные типы частиц, несущих на своей поверхности ДНК; и инфекционные вирусы и бактерии, которые естественным образом переносят свою ДНК в клетку-хозяин, но которые были сконструированы для переноса любой интересующей молекулы ДНК.Обычно чужеродная ДНК представляет собой полную экспрессионную единицу, которая включает собственные цис-регуляторы (например, промотор), а также ген, который должен быть транскрибирован.
При работе с более крупными клетками голую ДНК можно также микроинъектировать в клетку с помощью специальной иглы. Другие методы используют векторов для транспортировки ДНК через мембрану. Обратите внимание, что слово «вектор», используемое здесь, относится к любому типу носителя, а не только к плазмидным векторам. Векторы для трансформации / трансфекции включают везикул , состоящих из липидов или других полимеров, окружающих ДНК; различные типы частиц, несущих на своей поверхности ДНК; и инфекционные вирусы и бактерии, которые естественным образом переносят свою ДНК в клетку-хозяин, но которые были сконструированы для переноса любой интересующей молекулы ДНК.Обычно чужеродная ДНК представляет собой полную экспрессионную единицу, которая включает собственные цис-регуляторы (например, промотор), а также ген, который должен быть транскрибирован.
Когда целью эксперимента является получение стабильного трансгенного эукариота (т. Е. Наследуемого), чужеродная ДНК должна быть встроена в хромосомы хозяина. Чтобы это произошло, чужеродная ДНК должна войти в ядро хозяина и рекомбинировать с одной из хроматид хозяина. У некоторых видов чужеродная ДНК вставляется в случайное место в хроматиде, вероятно, там, где происходит разрыв цепи и негомологичное соединение концов.У других видов чужеродная ДНК может быть нацелена на конкретный локус, фланкируя чужеродную ДНК ДНК, гомологичной ДНК хозяина в этом локусе. Затем чужеродная ДНК включается в хромосомы хозяина посредством гомологичной рекомбинации.
Е. Наследуемого), чужеродная ДНК должна быть встроена в хромосомы хозяина. Чтобы это произошло, чужеродная ДНК должна войти в ядро хозяина и рекомбинировать с одной из хроматид хозяина. У некоторых видов чужеродная ДНК вставляется в случайное место в хроматиде, вероятно, там, где происходит разрыв цепи и негомологичное соединение концов.У других видов чужеродная ДНК может быть нацелена на конкретный локус, фланкируя чужеродную ДНК ДНК, гомологичной ДНК хозяина в этом локусе. Затем чужеродная ДНК включается в хромосомы хозяина посредством гомологичной рекомбинации.
Кроме того, для получения многоклеточных организмов, в которых все клетки являются трансгенными, а трансген стабильно наследуется, клетка, которая была первоначально трансформирована, должна быть либо гаметой, либо должна развиваться в ткани, которые продуцируют гаметы.Трансгенные гаметы в конечном итоге могут быть скрещены с получением гомозиготного трансгенного потомства. Присутствие трансгена в потомстве обычно подтверждают с помощью ПЦР или Саузерн-блоттинга, а экспрессию трансгена можно измерить с помощью ПЦР с обратной транскрипцией (ОТ-ПЦР), РНК-блоттинга и Вестерн-блоттинга.
Скорость транскрипции трансгена в значительной степени зависит от состояния хроматина, в который он вставлен (т. Е. Эффекты положения ), а также других факторов.Поэтому исследователи часто создают несколько независимо трансформированных / трансфицированных линий с одним и тем же трансгеном, а затем проводят скрининг линий с наивысшей экспрессией. Также хорошей практикой является клонирование и секвенирование трансгенного локуса из вновь созданного трансгенного организма, поскольку ошибки (усечения, перестройки и другие мутации) могут быть внесены во время трансформации / трансфекции.
Получение трансгенного растения
Наиболее распространенный метод получения трансгенных растений — это Agrobacterium-опосредованная трансформация (Рисунок \ (\ PageIndex {1} \)). Agrobacterium tumifaciens — почвенная бактерия, которая в рамках своего естественного патогенеза вводит свою собственную опухоль-индуцирующую плазмиду ( T i ) в клетки растения-хозяина. Природная плазмида T i кодирует гены, способствующие росту, которые вызывают образование галла (т.е. опухоли) на растении, что также обеспечивает среду для размножения патогена. Молекулярные биологи сконструировали плазмиду T i , удалив индуцирующие опухоль гены и добавив сайты рестрикции, которые позволяют удобно вставлять любую интересующую ДНК.Эта сконструированная версия называется плазмидой Т-ДНК (переносимая ДНК); Бактерия переносит линейный фрагмент этой плазмиды, который включает консервативные последовательности ДНК «левой границы (LB)» и правой границы (RB), а также все, что между ними (примерно до 10 т.п.н.). Линейный фрагмент Т-ДНК транспортируется в ядро, где он рекомбинирует с ДНК-хозяином, вероятно, там, где в хромосомах хозяина происходят случайные разрывы.
Природная плазмида T i кодирует гены, способствующие росту, которые вызывают образование галла (т.е. опухоли) на растении, что также обеспечивает среду для размножения патогена. Молекулярные биологи сконструировали плазмиду T i , удалив индуцирующие опухоль гены и добавив сайты рестрикции, которые позволяют удобно вставлять любую интересующую ДНК.Эта сконструированная версия называется плазмидой Т-ДНК (переносимая ДНК); Бактерия переносит линейный фрагмент этой плазмиды, который включает консервативные последовательности ДНК «левой границы (LB)» и правой границы (RB), а также все, что между ними (примерно до 10 т.п.н.). Линейный фрагмент Т-ДНК транспортируется в ядро, где он рекомбинирует с ДНК-хозяином, вероятно, там, где в хромосомах хозяина происходят случайные разрывы.
 Бактериальную культуру и растительную ткань (например, листовой пуансон) совместно культивируют на питательной среде в чашке Петри. Некоторые из растительных клеток будут инфицированы бактерией, которая перенесет Т-ДНК в цитоплазму растения. В некоторых случаях трансген интегрируется в хромосомную ДНК растительной клетки. В присутствии определенных комбинаций гормонов растительные клетки дедифференцируются в массу клеток, называемую каллусом.Присутствие селективного агента (например, гербицида или антибиотика) в питательной среде предотвращает деление нетрансформированных клеток. Следовательно, каждый каллус в идеале состоит только из трансгенных растительных клеток. Устойчивые каллусы переносятся в среду с другими комбинациями гормонов, которые способствуют органогенезу, то есть дифференцировке каллусных клеток в побеги, а затем в корни. Регенерированные трансгенные растения переносят в почву. Их семена можно собрать и протестировать, чтобы убедиться, что трансген унаследован стабильно.
Бактериальную культуру и растительную ткань (например, листовой пуансон) совместно культивируют на питательной среде в чашке Петри. Некоторые из растительных клеток будут инфицированы бактерией, которая перенесет Т-ДНК в цитоплазму растения. В некоторых случаях трансген интегрируется в хромосомную ДНК растительной клетки. В присутствии определенных комбинаций гормонов растительные клетки дедифференцируются в массу клеток, называемую каллусом.Присутствие селективного агента (например, гербицида или антибиотика) в питательной среде предотвращает деление нетрансформированных клеток. Следовательно, каждый каллус в идеале состоит только из трансгенных растительных клеток. Устойчивые каллусы переносятся в среду с другими комбинациями гормонов, которые способствуют органогенезу, то есть дифференцировке каллусных клеток в побеги, а затем в корни. Регенерированные трансгенные растения переносят в почву. Их семена можно собрать и протестировать, чтобы убедиться, что трансген унаследован стабильно.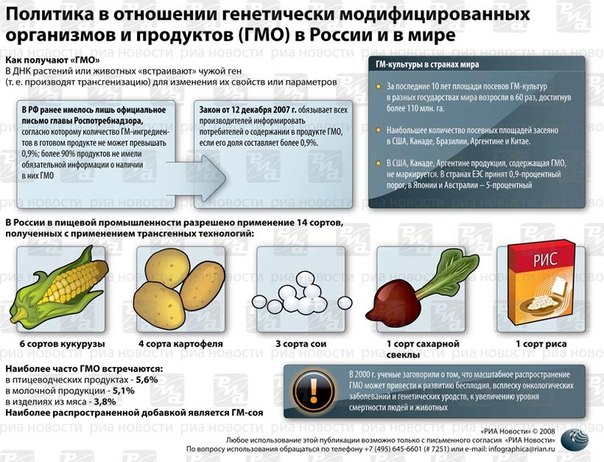 (Original-Deyholos-CC: AN)
(Original-Deyholos-CC: AN) У Arabidopsis и некоторых других видов цветы можно просто окунуть в суспензию Agrobacterium, и ~ 1% полученных семян будет трансформирован. У большинства других видов растений под действием гормонов клетки образуют массу недифференцированных тканей, называемую каллусом. Agrobacterium наносится на каллус, и несколько клеток трансформируются, что затем может быть вызвано другими гормонами для регенерации целых растений (рис. \ (\ PageIndex {2} \)). Некоторые виды растений устойчивы (т.е. « устойчивый ») к трансформации Agrobacterium. В этих ситуациях должны использоваться другие методы, такие как бомбардировка частицами , при которой ДНК нековалентно прикрепляется к небольшим металлическим частицам, которые ускоряются сжатым воздухом в каллусную ткань, из которой иногда могут быть регенерированы полные трансгенные растения. Во всех методах трансформации наличие селектируемого маркера (например, гена, придающего устойчивость к антибиотикам или гербицидам) полезно для отличия трансгенных клеток от нетрансгенных клеток на ранней стадии процесса трансформации.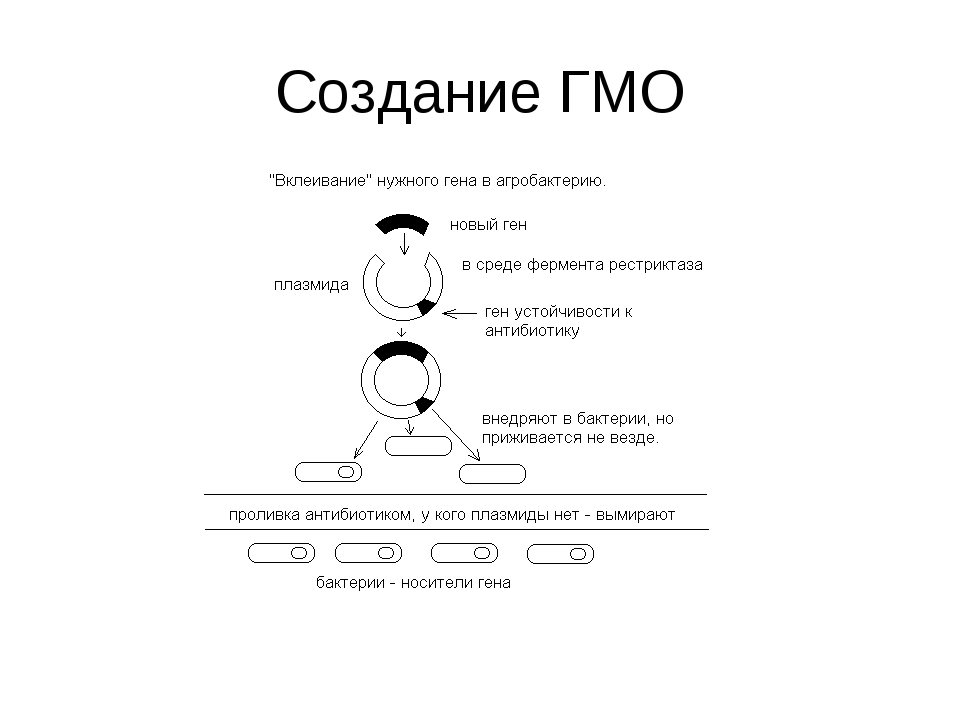
Получение трансгенной мыши
В широко используемом способе получения трансгенной мыши стволовых клеток удаляются из эмбриона мыши, и конструкция трансгенной ДНК переносится в стволовые клетки с помощью электропорации, и часть этой трансгенной ДНК попадает в ядро, где она может подвергаются гомологичной рекомбинации (Рисунок \ (\ PageIndex {3} \)). Конструкция трансгенной ДНК содержит ДНК, гомологичную любой стороне локуса, который подлежит замене.Если цель эксперимента состоит в простом удалении (« нокаут ») целевого локуса, ДНК хозяина можно просто заменить селективным маркером, как показано. Также возможно заменить ДНК хозяина в этом локусе другой версией того же гена или совершенно другим геном, в зависимости от того, как создана трансгенная конструкция. Клетки, которые были трансфицированы и экспрессируют селективный маркер (т.е.устойчивость к устойчивости к антибиотику неомицину, neoR, в этом примере), отличаются от неудачно трансфицированных клеток своей способностью выживать в присутствии селективного агента (например,грамм. антибиотик). Затем трансфицированные клетки вводят эмбрионам на ранних стадиях, а затем передают приемной матери. Полученные детеныши являются химерами, а это означает, что только некоторые из их клеток являются трансгенными. Некоторые из химер будут продуцировать трансгенные гаметы, которые при спаривании с гаметами дикого типа будут давать гемизиготных по трансгену мышей. В отличие от химер, эти гемизиготы несут трансген во всех своих клетках. Путем дальнейшего разведения можно получить мышей, гомозиготных по трансгену.
антибиотик). Затем трансфицированные клетки вводят эмбрионам на ранних стадиях, а затем передают приемной матери. Полученные детеныши являются химерами, а это означает, что только некоторые из их клеток являются трансгенными. Некоторые из химер будут продуцировать трансгенные гаметы, которые при спаривании с гаметами дикого типа будут давать гемизиготных по трансгену мышей. В отличие от химер, эти гемизиготы несут трансген во всех своих клетках. Путем дальнейшего разведения можно получить мышей, гомозиготных по трансгену.
 Эти устойчивые к неомицину клетки затем трансплантируются в другой эмбрион, который превращается в химеру у приемной матери. (Wikipedia-Kiaergaard-CC: AN)
Эти устойчивые к неомицину клетки затем трансплантируются в другой эмбрион, который превращается в химеру у приемной матери. (Wikipedia-Kiaergaard-CC: AN)Генная терапия человека
Многие различные стратегии генной терапии человека находятся в стадии разработки. Теоретически для трансфекции могут быть нацелены либо зародышевой линии , либо соматические клетки , но большинство исследований было сосредоточено на трансфекции соматических клеток из-за рисков и этических проблем, связанных с трансформацией зародышевой линии.Подходы к генной терапии могут быть дополнительно классифицированы как ex vivo или in vivo , причем первый означает, что клетки (например, стволовые клетки) трансфицируются изолированно перед введением в организм, где они заменяют дефектные клетки. . Ex vivo генные препараты для лечения некоторых заболеваний крови (например, иммунодефицитных состояний, талассемии) проходят клинические испытания. Для терапий in vivo трансфекция происходит внутри пациента.Целью может быть либо стабильная интеграция, либо неинтегративная трансфекция . Как описано выше, стабильная трансфекция включает интеграцию в геном хозяина. В клиническом контексте стабильная интеграция может не потребоваться и несет с собой более высокий риск индуцирования мутаций либо в трансгене, либо в геноме хозяина). Напротив, временная трансфекция не включает в себя интеграцию в геном хозяина, и поэтому трансген может быть доставлен в клетку в виде РНК или ДНК.Преимущества доставки РНК включают отсутствие необходимости в промоторе для управления экспрессией трансгена. Помимо трансгенов мРНК, которые могут обеспечивать функциональную версию мутантного белка, большой интерес представляет доставка siRNA (малые ингибирующие РНК), которые можно использовать для заглушения определенных генов в геноме клетки-хозяина.
Для терапий in vivo трансфекция происходит внутри пациента.Целью может быть либо стабильная интеграция, либо неинтегративная трансфекция . Как описано выше, стабильная трансфекция включает интеграцию в геном хозяина. В клиническом контексте стабильная интеграция может не потребоваться и несет с собой более высокий риск индуцирования мутаций либо в трансгене, либо в геноме хозяина). Напротив, временная трансфекция не включает в себя интеграцию в геном хозяина, и поэтому трансген может быть доставлен в клетку в виде РНК или ДНК.Преимущества доставки РНК включают отсутствие необходимости в промоторе для управления экспрессией трансгена. Помимо трансгенов мРНК, которые могут обеспечивать функциональную версию мутантного белка, большой интерес представляет доставка siRNA (малые ингибирующие РНК), которые можно использовать для заглушения определенных генов в геноме клетки-хозяина.
Векторы для in vivo генной терапии должны быть способны доставлять ДНК или РНК в большую часть клеток-мишеней, не вызывая значительного иммунного ответа или не оказывая каких-либо токсических эффектов. В идеале векторы также должны обладать высокой специфичностью к целевому типу клеток. Векторы на основе вирусов (например, лентивирусов ) разрабатываются для лечения генов in vivo и ex vivo . Другие, невирусные векторы (например, везикулы и наночастицы) также разрабатываются для генной терапии.
В идеале векторы также должны обладать высокой специфичностью к целевому типу клеток. Векторы на основе вирусов (например, лентивирусов ) разрабатываются для лечения генов in vivo и ex vivo . Другие, невирусные векторы (например, везикулы и наночастицы) также разрабатываются для генной терапии.
Авторы и авторство
трансгенных животных | Резюме
Определение
Трансгенное животное — это животное, геном которого был изменен путем переноса гена или генов от другого вида или породы.
На фотографии показаны две трансгенные мыши, расположенные по обе стороны от обычной мыши. Трансгенные мыши были генетически модифицированы так, что они несут зеленый флуоресцентный белок, который светится зеленым в синем свете. Кредит: Ингрид Моен и др., BMC Cancer, 12/21 (2012), 1-10.
Важность
Трансгенные животные обычно используются в лаборатории в качестве моделей в биомедицинских исследованиях. Более 95 процентов из них — это генетически модифицированные грызуны, в основном мыши.Они являются важными инструментами для исследования болезней человека, которые используются для понимания функции генов в контексте восприимчивости к болезни, прогрессирования и определения реакции на терапевтическое вмешательство.
Более 95 процентов из них — это генетически модифицированные грызуны, в основном мыши.Они являются важными инструментами для исследования болезней человека, которые используются для понимания функции генов в контексте восприимчивости к болезни, прогрессирования и определения реакции на терапевтическое вмешательство.
Мыши также были генетически модифицированы для естественного производства человеческих антител для использования в качестве терапевтических средств. Семь из одиннадцати препаратов с моноклональными антителами, одобренных FDA в период с 2006 по 2011 год, были получены от трансгенных мышей.
Трансгенные сельскохозяйственные животные также исследуются как средство производства больших количеств сложных белков человека для лечения болезней человека.Такие терапевтические белки в настоящее время производятся в реакторах на основе клеток млекопитающих, но этот производственный процесс является дорогостоящим. Например, в 2008 году строительство нового завода по производству одного терапевтического белка на основе клеток оценивалось в сумму более 500 миллионов долларов США. Более дешевым вариантом будет разработка средств для производства рекомбинантных белков в молоке, крови или яйцах трансгенных животных. Однако до настоящего времени прогресс в этой области был медленным. На данный момент только два биомедицинских продукта получили одобрение регулирующих органов.Первым из них является человеческий антитромбин III, терапевтический белок, вырабатываемый в молоке трансгенных коз, который используется для предотвращения образования тромбов у пациентов с наследственным дефицитом антитромбина, получающих хирургическое вмешательство или находящихся в процессе родов. Относительно небольшое стадо коз (около 80) может обеспечить достаточное количество человеческого антитромбина III для всей Европы. Второй продукт представляет собой рекомбинантный ингибитор эстеразы С12 человека, продуцируемый в молоке трансгенных кроликов. Он используется для лечения наследственного ангиодема — редкого генетического заболевания, которое вызывает расширение кровеносных сосудов в крови и отек кожи.
Более дешевым вариантом будет разработка средств для производства рекомбинантных белков в молоке, крови или яйцах трансгенных животных. Однако до настоящего времени прогресс в этой области был медленным. На данный момент только два биомедицинских продукта получили одобрение регулирующих органов.Первым из них является человеческий антитромбин III, терапевтический белок, вырабатываемый в молоке трансгенных коз, который используется для предотвращения образования тромбов у пациентов с наследственным дефицитом антитромбина, получающих хирургическое вмешательство или находящихся в процессе родов. Относительно небольшое стадо коз (около 80) может обеспечить достаточное количество человеческого антитромбина III для всей Европы. Второй продукт представляет собой рекомбинантный ингибитор эстеразы С12 человека, продуцируемый в молоке трансгенных кроликов. Он используется для лечения наследственного ангиодема — редкого генетического заболевания, которое вызывает расширение кровеносных сосудов в крови и отек кожи.
Discovery
Возможность производить трансгенных животных зависит от ряда компонентов. Одна из первых вещей, необходимых для создания трансгенных животных, — это способность переносить эмбрионы. Первый успешный перенос эмбрионов был осуществлен Уолтером Хипом на ангорских кроликах в 1891 году. Другой важный компонент — это способность манипулировать эмбрионом. Впервые о манипуляциях с эмбрионами мышей in vitro сообщили в 1940-х годах с использованием системы культивирования. Что также важно, так это умение манипулировать яйцами.Это стало возможным благодаря усилиям Ральфа Бринстера из Пенсильванского университета, который в 1963 году разработал надежную систему культивирования яиц, и Тэ Пинг Линь из Калифорнийской школы медицины, который в 1966 году изложил методику для микроинъекции оплодотворенных яиц мышей, что позволило точно ввести чужеродную ДНК.
О первой генетической модификации животных сообщили в 1974 году вирусолог Рудольф Джениш из Института Солка и мышиный эмбриолог Беатрис Минц из онкологического центра Фокс Чейз. Они продемонстрировали возможность модификации генов у мышей путем инъекции вируса SV40 в мышиные эмбрионы на ранней стадии. Полученные мыши несли модифицированный ген во всех своих тканях. В 1976 году Джениш сообщил, что вирус лейкемии мышей Молони также может передаваться потомству при инфицировании эмбриона. Четыре года спустя, в 1980 году, Джон Гордон и Джордж Сканго вместе с Фрэнком Раддлом объявили о рождении мыши, родившейся с генетическим материалом, который они вставили в только что оплодотворенные яйца мыши.К 1981 году другие ученые сообщили об успешной имплантации чужеродной ДНК мышам, что изменило генетический состав животных. Это включало Минца с Тимом Стюартом и Эрвином Вагнером в онкологическом центре Fox Chase в Филадельфии; Бринстер и Ричард Палмитер из Вашингтонского университета в Сиэтле; и Фрэнк Костантини и Элизабет Лейси из Оксфордского университета.
Они продемонстрировали возможность модификации генов у мышей путем инъекции вируса SV40 в мышиные эмбрионы на ранней стадии. Полученные мыши несли модифицированный ген во всех своих тканях. В 1976 году Джениш сообщил, что вирус лейкемии мышей Молони также может передаваться потомству при инфицировании эмбриона. Четыре года спустя, в 1980 году, Джон Гордон и Джордж Сканго вместе с Фрэнком Раддлом объявили о рождении мыши, родившейся с генетическим материалом, который они вставили в только что оплодотворенные яйца мыши.К 1981 году другие ученые сообщили об успешной имплантации чужеродной ДНК мышам, что изменило генетический состав животных. Это включало Минца с Тимом Стюартом и Эрвином Вагнером в онкологическом центре Fox Chase в Филадельфии; Бринстер и Ричард Палмитер из Вашингтонского университета в Сиэтле; и Фрэнк Костантини и Элизабет Лейси из Оксфордского университета.
Такая работа заложила основу для создания трансгенных мышей, генетически модифицированных для наследования определенных форм рака. Эти мыши были созданы в качестве лабораторного инструмента для лучшего понимания возникновения и прогрессирования рака. Преимущество таких мышей состоит в том, что они представляют собой модель, максимально имитирующую человеческое тело. Мыши не только дают возможность лучше понять рак, но и тестировать экспериментальные лекарства.
Эти мыши были созданы в качестве лабораторного инструмента для лучшего понимания возникновения и прогрессирования рака. Преимущество таких мышей состоит в том, что они представляют собой модель, максимально имитирующую человеческое тело. Мыши не только дают возможность лучше понять рак, но и тестировать экспериментальные лекарства.
Заявка
Трансгенные животные — это животные (чаще всего мыши), в геном которых намеренно вставлен чужеродный ген. Такие животные чаще всего создаются путем микроинъекции ДНК в пронуклеусы оплодотворенной яйцеклетки, которая впоследствии имплантируется в яйцевод псевдобеременной суррогатной матери.Это приводит к тому, что животное-реципиент рождает генетически модифицированное потомство. Затем потомство скрещивают с другим трансгенным потомством для создания трансгенной линии. Трансгенные животные также могут быть созданы путем встраивания ДНК в эмбриональные стволовые клетки, которые затем вводятся микроинъекциями в эмбрион, который развился в течение пяти или шести дней после оплодотворения, или путем инфицирования эмбриона вирусами, несущими интересующую ДНК. Этот последний метод обычно используется для манипулирования одним геном, в большинстве случаев он включает удаление или «нокаут» целевого гена.Конечным результатом является так называемое животное «нокаут».
Этот последний метод обычно используется для манипулирования одним геном, в большинстве случаев он включает удаление или «нокаут» целевого гена.Конечным результатом является так называемое животное «нокаут».
С середины 1980-х годов трансгенные мыши стали ключевой моделью для исследования болезней. Мыши являются предпочтительной моделью не только потому, что существует обширный анализ ее завершенной геномной последовательности, но и потому, что ее геном аналогичен человеческому. Более того, физиологические и поведенческие тесты, проведенные на мышах, можно экстраполировать непосредственно на болезнь человека. Также легко доступны надежные и сложные методы для обычных манипуляций с клетками мыши и эмбрионами.Еще одним преимуществом мышей является то, что у них короткий цикл размножения. Также используются другие трансгенные виды, такие как свиньи, овцы и крысы, но их использование в фармацевтических исследованиях до сих пор ограничено из-за технических ограничений. Однако последние технологические достижения закладывают основу для более широкого внедрения трансгенных крыс.
Трансгенные грызуны играют важную роль в открытии и разработке лекарств. Важно отметить, что они позволяют ученым изучать функции конкретных генов на уровне всего организма, что способствует изучению физиологии и биологии болезней и облегчает идентификацию новых мишеней для лекарств.Из-за сходства физиологии и функций генов человека и грызунов трансгенные грызуны могут имитировать человеческое заболевание. Действительно, для этой цели был создан ряд моделей трансгенных мышей. Мыши используются в качестве моделей, например, для изучения ожирения, болезней сердца, диабета, артрита, злоупотребления психоактивными веществами, беспокойства, старения, болезни Альцгеймера и болезни Паркинсона. Они также используются для изучения различных форм рака. Кроме того, трансгенные свиньи исследуются как источник органов для трансплантатов, которые, если они будут клинически безопасными, могут преодолеть серьезную нехватку донорских органов.Развитие трансгенных животных недавно изменилось с появлением нового инструмента редактирования генов CRISPR, который значительно сократил количество этапов создания трансгенных животных, сделав весь процесс намного быстрее и дешевле.
Этот раздел, посвященный трансгенным мышам, был совместно написан Ларой Маркс и Дмитрием Мельниковым. Для получения дополнительной информации см. Д. Мельников, «Трансформирующие мыши: техника и коммуникация при создании трансгенных животных, 1974-1988», неопубликованная докторская диссертация, Кембриджский университет, 2015.
Трансгенные животные: хронология ключевых событий
| Дата | Событие | Люди | Мест |
|---|---|---|---|
| 23 июня 1925 г. | Оливер Смитис родился в Галифаксе, Великобритания | Смитес | Вашингтонский университет, Университет Северной Каролины |
| 1929 | «/> Мемориальные лаборатории Джексона, созданные для разработки инбредных линий мышей для изучения генетики рака и других заболеваний | Мемориальные лаборатории Джексона | |
| 19 августа 1929 г. | Ruddle also discovered, with William McGinnis, the first human homeobox genes, important regulators of gene development. «/> Фрэнк Раддл родился в Западном Нью-Йорке, штат Нью-Джерси | Раддл | Йельский университет |
| 18 сен 1951 | Clark also managed to develop the first large transgenic animal, a sheep, in which a prion protein gene had been improved. «/> Энтони Кларк родился в Блэкпуле, Великобритания | Энтони Кларк | Институт Рослина |
| 1974 | Первая публикация по внедрению чужеродной ДНК в мышей | Jaenisch, Mintz | Институт Солка, Институт исследования рака Фокса Чейза |
| Сентябрь 1980 г. | Ученые сообщили о первом успешном развитии трансгенных мышей | Barbosa, Gordon, Plotkin, Ruddle, Scangos | Йельский университет |
| Ноябрь 1980 г. | Методика, опубликованная с использованием тонких стеклянных микропипеток для инъекции ДНК непосредственно в ядра культивируемых клеток млекопитающих. Высокая эффективность метода позволяет исследователям получать трансгенных мышей, содержащих случайные вставки экзогенной ДНК. | Capecchi | University of Utah |
5 ноября 1981 г. | Первый успешный передача чужеродной ДНК лабораторным мышам | Constantini, Lacy | Оксфордский университет, Йельский университет |
| декабрь 1982 г. | Гигантские мыши, полученные с помощью инъекции гормона роста крыс | Brinster, Палмитер | Пенсильванский университет, Вашингтонский университет Сиэтл |
| 1983 | Начало курса молекулярной эмбиологии мышей | Costantini, Hogan, Lacy | Лаборатория Колд-Спринг-Харбор, НИМИ, Центр исследования рака Слоан-Кеттеринг, Колумбийский университет |
| 1985 | Первые трансгенные мыши, созданные с генами, кодирующими домены как тяжелой, так и легкой цепи в антителе. | Kohler, Rusconi | Max-Planck Institute |
| 6 ноября 1987 г. | Публикация метода нацеливания на гены для нацеливания на мутации в любом гене | Томас, Капеччи | Университет штата Юта |
| 1988 | Подана заявка на патент на метод создания трансгенных мышей для продукции человеческих антител | Bruggeman, Caskey, Neuberger, Surani, Teale, Waldmann, Williams | Laboratory of Molecular Биология, Институт Бабрахама, Кембриджский университет |
| 12 апр 1988 | Выдан патент OncoMouse | Ледер, Стюарт | Гарвардский университет |
| 12 июня 1992 г. | E. Li, T.H. Bestor, R. Jaenisch, ‘Targeted mutation of the DNA methyltransferase gene results in embryonic lethality’, Cell, 69/6 (1992), 915-26.»/> Первый трансгенный Модель мыши создана для изучения связи между метилированием ДНК и заболеванием | Li, Bestor, Jaenisch | Институт биомедицинских исследований Уайтхеда |
| 1994 | Two of the teams are based in biotechnology companies: GenPharm (led by Nils Lonsberg), Cell Gensys (led by Larry Green) , and the other involved a collaboration (led by Marian Bruggemann and Michael Neuberger) between scientists at the Laboratory of Molecular Biology, Braham Institute and the University of Cologne.»/> Сообщается о первых линиях трансгенных мышей, продуцирующих человеческие моноклональные антитела | Bruggemann, S.Green, Lonsberg, Neuberger | Cell Genesys, GenPharm , Лаборатория молекулярной биологии |
| 5 июля 1996 г. | This was done by transferring the nucleus of an adult sheep’s cell to the nucleus of an unfertilised egg cell. It took 277 attempts to achieve success. The work was carried out by Keith Campbell, Ian Wilmut and colleagues at the Rosilin Institute, PPL Therapeutics and the Ministry of Agriculture. «/> Родилась овца Долли, первое клонированное млекопитающее | Уилмут, Кэмпбелл | Институт Рослина |
| 9 июля 1997 г. | Рождение первой овцы, клонированной с человеческими генами | Шник, Кинд, Ричи, Микок, Скотт, Уилмут, Колман, Кэмпбелл | PPL Therapeutics, Roslin Institute |
| 14 февраля 2003 г. | Умерла овца Долли, первое клонированное млекопитающее. | Уилмут | Институт Рослина |
12 августа 2004 г. | Энтони Дж. Кларк умер | Энтони Кларк | Институт Рослина |
| Сентябрь 2006 г. | The drug is a fully human monoclonal antibody created with transgenic mice. It was developed by Agensys with Amgen. «/> Утвержден первый препарат с полностью человеческими моноклональными антителами | Agensys, Amgen | |
| 2007 | «/> Нобелевская премия по физиологии и медицине присуждена за открытия, позволяющие модифицировать ген зародышевой линии у мышей с использованием эмбриональных стволовых клеток | Капеччи, Эванс, Smithies | Университет Северной Каролины, Университет Юты |
| 10 марта 2013 г. | Gordon and George Scango the first successful transgenic mouse. This heralded the development of genetically modified animals as research models to investigate the function of genes and genetic cause of disease. Ruddle also discovered, with William McGinnis, the first human homeobox genes, important regulators of gene development. «/> Фрэнк Раддл умер в Нью-Хейвене, Коннектикут | Раддл | Йельский университет |
| 26 октября 2013 г. | His work paved the way for the generation of safer and more effective monoclonal antibody drugs. «/> Майкл Нойбергер умер | Нойбергер | Лаборатория молекулярной биологии |
| 23 сентября 2015 г. | Пекинский институт геномики объявил о продаже первых микропоросин, созданных с помощью технологии редактирования генов TALENs | Пекинский институт геномики | |
| 5 октября 2015 г. | CRISPR / Cas9 модифицировал 60 генов в эмбрионах свиней на первом этапе создания органов, подходящих для трансплантации человеку | Church | Гарвардский университет |
| 10 января 2017 г. | His method facilitated the creation of thousands of lines of mice carrying desired genetic mutations. Such mice are now widely used to investigate the role of many different genes in human health and disease. «/> Оливер Смитис умер | Smithies | Вашингтонский университет, Университет Северной Каролины |
| 20 апреля 2017 г. | Исследование диабета с использованием трансгенных мышей показывает, что белок P2X7R играет важную роль в воспалении и иммунной системе, предлагая новый путь лечения заболеваний почек | Мензис | Эдинбургский университет, Университет Колледж Лондон, Имперский колледж |
| 23 января 2019 г. | CRISPR-Cas9, используемый для контроля генетического наследования у мышей | Грюнвальд, Гнтц, Поплавски, Сюй, Бир, Купер | Калифорнийский университет Сан-Диего |
Оливер Смитис родился в Галифаксе, Соединенное Королевство
Jackson Memorial Laboratories была создана для разработки инбредных линий мышей для изучения генетики рака и других заболеваний
Фрэнк Раддл родился в Западном Нью-Йорке, Нью-Джерси
Энтони Дж. Кларк был родился в Блэкпуле, Великобритания
Кларк был родился в Блэкпуле, Великобритания
Первая публикация о введении чужеродной ДНК в мышей
Ученые сообщили о первой успешной разработке трансгенных мышей
Опубликована методика с использованием тонких стеклянных микропипеток для инъекции ДНК непосредственно в ядра культивируемых клеток млекопитающих.Высокая эффективность метода позволяет исследователям получать трансгенных мышей, содержащих случайные вставки экзогенной ДНК.
Первая успешная передача чужеродной ДНК лабораторным мышам
Гигантские мыши, полученные с помощью инъекции гормона роста крыс
Начался курс молекулярной эмбиологии мышей
Первые трансгенные мыши, созданные с генами, кодирующими как тяжелую, так и легкую цепь домены в антителе.
Публикация метода нацеливания на гены для нацеливания на мутации в любом гене
Подана заявка на патент на метод создания трансгенных мышей для продукции человеческих антител
Первая модель трансгенной мыши, созданная для изучения связи между метилированием ДНК и заболеванием
Первая трансгенная штаммы мышей, о которых сообщается, что они продуцируют человеческие моноклональные антитела
Родилась овца Долли, первое клонированное млекопитающее
Рождение первой овцы, клонированной с человеческими генами
Овца Долли, первое клонированное млекопитающее, умерла
Первое полностью человеческое моноклональное антитело препарат утвержден
Нобелевская премия по физиологии и медицине присуждена за открытия, позволяющие модифицировать ген зародышевой линии у мышей с использованием эмбриональных стволовых клеток
Фрэнк Раддл умер в Нью-Хейвене, Коннектикут
Пекинский институт геномики объявил о продаже первых микропоросин, созданных с помощью Техника редактирования генов TALENs 900 05
CRISPR / Cas9 модифицировал 60 генов в эмбрионах свиней на первом этапе создания органов, подходящих для трансплантации человеку
Исследования диабета с использованием трансгенных мышей показывают, что белок P2X7R играет важную роль в воспалении и иммунной системе, предлагая новые возможности для лечения заболеваний почек
CRISPR -Cas9 используется для контроля генетической наследственности у мышей
6.
 3 ТРАНСГЕННЫЕ МЫШИ, ОБРАЗУЮЩИЕСЯ ЯДЕРНОЙ ИНЪЕКЦИЕЙ 6.3 ТРАНСГЕННЫЕ МЫШИ, ОБРАЗУЮЩИЕСЯ ЯДЕРНОЙ ИНЪЕКЦИЕЙ
3 ТРАНСГЕННЫЕ МЫШИ, ОБРАЗУЮЩИЕСЯ ЯДЕРНОЙ ИНЪЕКЦИЕЙ 6.3 ТРАНСГЕННЫЕ МЫШИ, ОБРАЗУЮЩИЕСЯ ЯДЕРНОЙ ИНЪЕКЦИЕЙ6.3 ТРАНСГЕННЫЕ МЫШИ, ОБРАЗУЮЩИЕСЯ ЯДЕРНОЙ ИНЪЕКЦИЕЙ
Всем методам классического мутагенеза присущи две проблемы. Первая проблема заключается в том, что процесс совершенно случайно. Таким образом, нужно начинать с разработки скринингового анализа, позволяющего обнаруживать мутации. в интересующем локусе, и тогда нужно надеяться на появление мутантных животных с частотой, равной, или выше, обычная частота на локус.Если мутантный аллель не дает фенотипа, который может быть уловлен экран, он останется незамеченным. Наконец, даже при обнаружении мутантных аллелей основное поражение обычно может невозможно установить без клонирования и дальнейшей молекулярной характеристики.
Вторая проблема классического мутагенеза заключается в том, что индуцированные мутации никоим образом не помечаются, чтобы обеспечить
молекулярный вход в локус, который еще не был клонирован. Таким образом, если новый локус обнаружен индуцированной мутацией
что вызывает интересный фенотип, к нему можно подойти только через ген-кандидат и позиционное клонирование
подходит так же, как и любой другой фенотипически определенный локус.Кроме того, в случае мутаций, вызванных ENU,
мутантные аллели и аллели дикого типа, вероятно, будут неразличимы на молекулярном уровне, за исключением одного
нуклеотид, который может или не может влиять на сайт рестрикции.
Таким образом, если новый локус обнаружен индуцированной мутацией
что вызывает интересный фенотип, к нему можно подойти только через ген-кандидат и позиционное клонирование
подходит так же, как и любой другой фенотипически определенный локус.Кроме того, в случае мутаций, вызванных ENU,
мутантные аллели и аллели дикого типа, вероятно, будут неразличимы на молекулярном уровне, за исключением одного
нуклеотид, который может или не может влиять на сайт рестрикции.
Можно представить два типа мутагенных подходов, которые были бы наиболее идеальными для двух разных типов ситуаций.
в которых мутации могут предоставить инструменты для молекулярного анализа развития и других аспектов биологии млекопитающих. На
с одной стороны, подход случайного мутагенеза хорош для выяснения новых локусов при условии, что мутантный аллель
помечены, чтобы обеспечить прямой молекулярный доступ.С другой стороны, для дальнейшего анализа локуса, который уже клонирован и
охарактеризовано, хотелось бы получить животных, которые некорректно экспрессируют локус определенным образом. Технологии
вставки трансгена и нацеливания на гены предоставили генетикам инструменты, необходимые для выполнения обоих этих задач.
цели.
Технологии
вставки трансгена и нацеливания на гены предоставили генетикам инструменты, необходимые для выполнения обоих этих задач.
цели.
6.3.1 Обзор
В 1981 году пять независимых лабораторий сообщили о внедрении чужеродной ДНК в зародышевую линию мыши через
микроинъекция одноклеточных яиц
(Костантини и Лейси, 1981;
Гордон и Раддл, 1981;
Harbers et al., 1981;
Wagner et al., 1981a;
Wagner et al., 1981b).
Хотя о включении экзогенной ДНК в зародышевую линию в результате вирусной инфекции эмбрионов сообщалось ранее.
(Jaenisch, 1976),
отчеты 1981 г. впервые подразумевали, что ДНК из любого источника может быть использована для трансформации генома мыши.
С появлением этого мощного инструмента характер генетики мышей навсегда изменился. Строго наблюдательный
наука внезапно оказалась в сфере генной инженерии со всеми ее обширными последствиями.Включение
генетический материал в зародышевой линии мыши в настоящее время стал достаточно обычным, чтобы методология подробно описывалась в различных
«поваренные книги»
(Wassarman and DePamphilis, 1993;
Hogan et al. , 1994), а животные-дизайнеры даже предоставляются в качестве коммерческих услуг.
рядом компаний.
, 1994), а животные-дизайнеры даже предоставляются в качестве коммерческих услуг.
рядом компаний.
Термин трансгенный был придуман для описания животных, у которых есть чужеродные последовательности, стабильно вставленные в их геном через посредников человека. Трансгенные животные могут быть созданы путем микроинъекции или вирусного заражения эмбрионов, или посредством манипуляции с культурой эмбрионоподобных «ES-клеток», которые впоследствии снова включаются в эмбрион, подходящий для внедрения в зародышевую линию.Последняя технология будет обсуждаться в следующий раздел. Здесь Я сосредоточусь на трансгенных животных, созданных путем прямой инъекции ДНК в эмбрионы.
Первоначальное животное, которое развивается из каждого яйца, подвергшегося микроманипуляции, называется основателем . Даже когда несколько
все эмбрионы были инъецированы или инфицированы одной и той же чужеродной ДНК, сайтом интеграции — или локусом трансгена —
у каждого учредителя будет свое.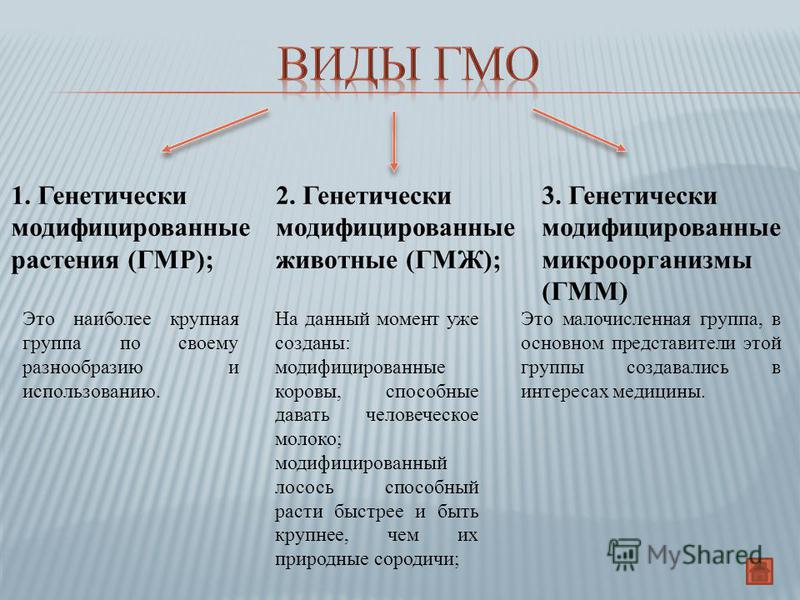 Однако все трансгенные животные, происходящие от одного основателя, будут иметь одинаковые
трансгенный локус.Протоколы создания трансгенных мышей, а также обширные обзоры технологии и ее использования
был описан в другом месте
(Палмитер и Бринстер, 1986;
Wassarman and DePamphilis, 1993;
Hogan et al., 1994).
Правила наименования локусов трансгенов и трансгенных животных представлены в
Раздел 3.4.
Однако все трансгенные животные, происходящие от одного основателя, будут иметь одинаковые
трансгенный локус.Протоколы создания трансгенных мышей, а также обширные обзоры технологии и ее использования
был описан в другом месте
(Палмитер и Бринстер, 1986;
Wassarman and DePamphilis, 1993;
Hogan et al., 1994).
Правила наименования локусов трансгенов и трансгенных животных представлены в
Раздел 3.4.
Согласно существующим протоколам создания трансгенных мышей с помощью микроинъекции эмбрионов, сайт интеграции не предопределены и для всех практических целей должны считаться случайными.Микроинъекция позволяет к добавить , но не вычитать генетический материал направленным образом; если конкретный эксперимент приводит к вставке романа версии гена мыши в геном, этот новый аллель будет присутствовать в дополнение к нормальной диплоидной паре. Следовательно, только доминантные или содоминантные формы фенотипической экспрессии будут обнаруживаться из трансгена.
Технология микроинъекции эмбрионов может использоваться для изучения многих различных аспектов биологии мышей и регуляции генов. Один класс экспериментов включает эксперименты, направленные на определение эффектов экспрессии продукта природного гена в организме человека.
неестественным образом. Комбинируя интересующий ген с регуляторными участками, выбранными из других генов, можно вызвать
трансгенные мыши для экспрессии продукта на более высоком, чем обычно уровне, уровне или в альтернативных тканях или стадиях развития.
Мутантные фенотипы, возникающие в результате таких аберрантных форм экспрессии, могут использоваться для выяснения нормальной функции
ген дикого типа.Эксперименты этого типа можно использовать, например, для демонстрации способности некоторых генов вызывать
специфические изменения развития и онкогенная природа других, когда они выражены аберрантно. Много других
На типы вопросов можно ответить с помощью этого подхода.
Один класс экспериментов включает эксперименты, направленные на определение эффектов экспрессии продукта природного гена в организме человека.
неестественным образом. Комбинируя интересующий ген с регуляторными участками, выбранными из других генов, можно вызвать
трансгенные мыши для экспрессии продукта на более высоком, чем обычно уровне, уровне или в альтернативных тканях или стадиях развития.
Мутантные фенотипы, возникающие в результате таких аберрантных форм экспрессии, могут использоваться для выяснения нормальной функции
ген дикого типа.Эксперименты этого типа можно использовать, например, для демонстрации способности некоторых генов вызывать
специфические изменения развития и онкогенная природа других, когда они выражены аберрантно. Много других
На типы вопросов можно ответить с помощью этого подхода.
В другом классе экспериментов можно выделить функцию регуляторной области путем формирования конструкций между
он и репортерный ген, экспрессия которого может быть легко проанализирована в соответствующей ткани (ах). С серией трансгенных
линий, которые имеют частично удаленные или мутировавшие формы регуляторной области, можно точно определить, какие последовательности ДНК
участвует в включении и выключении генов в различных тканях или на разных стадиях развития.
С серией трансгенных
линий, которые имеют частично удаленные или мутировавшие формы регуляторной области, можно точно определить, какие последовательности ДНК
участвует в включении и выключении генов в различных тканях или на разных стадиях развития.
Треть класса экспериментов направлена на исправление генетического дефекта у мутантной мыши с помощью геномной вставка трансгена дикого типа. Это использование трансгенной технологии обеспечивает самые мощные доступные средства. чтобы доказать, что клонированный ген-кандидат действительно идентичен локусу, ответственному за конкретный мутантный фенотип. Кроме того, исправление генетических дефектов у модельных млекопитающих является необходимой прелюдией к любой попытке выполнить аналогичные действия. исследования на людях.
Важное соображение во всех трансгенных экспериментах следует из наблюдения, что фактическая хромосомная
место, в котором вставки трансгена могут играть определяющую роль в его экспрессии. Это будет очевидно в
случаи, когда разные линии-основатели с одним и тем же трансгеном показывают разные паттерны экспрессии трансгена. Причина
для таких специфичных для штаммов различий заключается в том, что некоторые хромосомные области обычно сохраняются в конфигурациях хроматина.
которые могут подавлять активность генов.Различные трансгенные конструкции будут демонстрировать разные уровни чувствительности к
подавление активности при приземлении в таких регионах.
Причина
для таких специфичных для штаммов различий заключается в том, что некоторые хромосомные области обычно сохраняются в конфигурациях хроматина.
которые могут подавлять активность генов.Различные трансгенные конструкции будут демонстрировать разные уровни чувствительности к
подавление активности при приземлении в таких регионах.
Другая потенциальная проблема может возникнуть в результате внедрения трансгена в нормально функционирующий эндогенный
локус с непредвиденными последствиями. Примерно в 5-10% всех изученных на сегодняшний день случаев гомозиготность по
Было обнаружено, что конкретный локус трансгена вызывает летальность или некоторые другие фенотипические аномалии.
(Палмитер и Бринстер, 1986). Эти рецессивные фенотипы, скорее всего, связаны с
нарушение какого-то нормального жизненно важного гена.В менее частых случаях трансген может приземлиться на участке, примыкающем к
эндогенный энхансер, который может стимулировать активность гена на несоответствующих стадиях или тканях. Это может привести к выражению
доминантных фенотипов, которые не являются строго результатом самого трансгена. 39 По всем этим причинам очень важно
для анализа данных от трех или более линий-основателей с одной и той же трансгенной конструкцией, прежде чем делать выводы относительно
влияние или отсутствие такового на фенотип мыши.
Это может привести к выражению
доминантных фенотипов, которые не являются строго результатом самого трансгена. 39 По всем этим причинам очень важно
для анализа данных от трех или более линий-основателей с одной и той же трансгенной конструкцией, прежде чем делать выводы относительно
влияние или отсутствие такового на фенотип мыши.
В подавляющем большинстве случаев, проанализированных на сегодняшний день, нарушение эндогенных последовательностей, вызванное трансгеном
интеграция не оказала видимого влияния на фенотип. Однако отсутствие детектируемого фенотипа не
обязательно означает, что трансген интегрировался в нефункциональную область генома. Как обсуждалось в
Глава 5, только небольшая часть всех генов млекопитающих на самом деле vital , и тонкие эффекты на фенотип, вероятно, останутся незамеченными, если выполнить только поверхностное исследование
трансгенные животные.Таким образом, реальная частота инсерционного мутагенеза в результате микроинъекции эмбриона составляет
вероятно, будет значительно выше, чем предполагают цифры.
6.3.2 Отслеживание трансгена и обнаружение гомозигот
Если конкретная трансгенная вставка не вызывает легко определяемый доминантный фенотип, присутствие трансгена у животного легче всего определить с помощью анализа ДНК. Для тестирования большого количества мышей лучшим источником ДНК является от обрезков хвоста или выбивки ушей (Гендрон-Магуайр и Гридли, 1993).Наличие или отсутствие трансгена наиболее эффективно можно продемонстрировать с помощью метода ПЦР-анализа, основанного на трансген-специфичных целевых последовательностях.
Животное-основание трансгенной линии будет гетерозиготным по локусу инсерции трансгена. Второй гомолог будет
быть ассоциированным с неразрушенным аллелем «дикого типа» (+) в этом локусе, тогда как поврежденная хромосома будет нести
аллель трансгена ( Tg ). Пока трансген передается потомству от гетерозиготной ( Tg / +)
родитель, необходимо будет тестировать каждое отдельное животное каждого нового поколения на наличие трансгена. Только по этой причине было бы полезно получить животных, гомозиготных по аллелю трансгена, поскольку все потомки
от вязок между гомозиготными Tg / Tg животными также будут гомозиготными, и не будет необходимости в
ДНК-тестирование.
Только по этой причине было бы полезно получить животных, гомозиготных по аллелю трансгена, поскольку все потомки
от вязок между гомозиготными Tg / Tg животными также будут гомозиготными, и не будет необходимости в
ДНК-тестирование.
В редких случаях гомозиготные животные с Tg / Tg будут фенотипически отличаться от их когорт с Tg / +. Это наблюдение обычно является хорошим признаком того, что трансген нарушил функцию эндогенного локуса через процесс интеграции.Если гомозиготный рецессивный фенотип летален, очевидно, что будет невозможно создать гомозиготная линия животных. В противном случае фенотип может исключить необходимость анализа ДНК. В подавляющем большинстве случаев однако гомозиготные Tg / Tg животные будут неотличимы по фенотипу от гетерозиготных Tg / + животных, и без рецессивного фенотипа идентификация гомозиготных животных не будет простой.
Один из подходов к подтверждению генотипа предполагаемого животного с Tg / Tg основан на статистической генетике. В этом случае подтверждение достигается путем установления спаривания между предполагаемой гомозиготой и нетрансгенным
+ / + партнер. Если рассматриваемое животное представляет собой только гетерозиготу с Tg / +, можно ожидать равное количество Tg / +.
и + / + потомство. С помощью метода анализа хи-квадрат, описанного в
В разделе 9.1.3 можно подсчитать, что если родится по крайней мере 13 потомков, и все они будут иметь
трансген, вероятность гетерозиготного генотипа составляет менее одного из тысячи. 40 Если получится хоть одно животное
без трансгена генотип родителя почти наверняка будет Tg / +. Статистическое тестирование такого рода
должны выполняться независимо для каждого предполагаемого Tg / Tg животного. Один раз гомозиготный Tg / Tg подтверждены самцы и самки, они могут быть повторно скрещены друг с другом как основатели гомозиготного трансгенного штамма.
В этом случае подтверждение достигается путем установления спаривания между предполагаемой гомозиготой и нетрансгенным
+ / + партнер. Если рассматриваемое животное представляет собой только гетерозиготу с Tg / +, можно ожидать равное количество Tg / +.
и + / + потомство. С помощью метода анализа хи-квадрат, описанного в
В разделе 9.1.3 можно подсчитать, что если родится по крайней мере 13 потомков, и все они будут иметь
трансген, вероятность гетерозиготного генотипа составляет менее одного из тысячи. 40 Если получится хоть одно животное
без трансгена генотип родителя почти наверняка будет Tg / +. Статистическое тестирование такого рода
должны выполняться независимо для каждого предполагаемого Tg / Tg животного. Один раз гомозиготный Tg / Tg подтверждены самцы и самки, они могут быть повторно скрещены друг с другом как основатели гомозиготного трансгенного штамма.
Второй подход к демонстрации гомозиготности трансгена требует клонирования эндогенной последовательности мыши. геном, фланкирующий сайт встраивания трансгена.Эта задача часто бывает непростой, поскольку трансгенный материал может
присутствовать в множестве копий, которые перемешаны с локально реаранжированными эндогенными последовательностями. Тем не менее, с
клонируя любую ближайшую эндогенную последовательность, можно получить инструмент картирования, который теоретически может быть использован для различения как
нарушенные и не нарушенные аллели в локусе трансгена с использованием одного из различных методов, описанных в
Глава 8
(8.2,
8.3) для выявления «кодоминантных» полиморфизмов ДНК.С таким
инструмента и связанного с ним анализа, гомозиготность по аллелю трансгена будет продемонстрирована отсутствием аллеля дикого типа
неразрушенный аллель. К сожалению, этот подход потребует создания отдельного эндогенного клона для каждого и
каждая трансгенная линия подлежит изучению. Протоколы для определения местоположения сайта вставки трансгена на карте сцепления мыши:
обсуждается в
Раздел 7.3.2.
геном, фланкирующий сайт встраивания трансгена.Эта задача часто бывает непростой, поскольку трансгенный материал может
присутствовать в множестве копий, которые перемешаны с локально реаранжированными эндогенными последовательностями. Тем не менее, с
клонируя любую ближайшую эндогенную последовательность, можно получить инструмент картирования, который теоретически может быть использован для различения как
нарушенные и не нарушенные аллели в локусе трансгена с использованием одного из различных методов, описанных в
Глава 8
(8.2,
8.3) для выявления «кодоминантных» полиморфизмов ДНК.С таким
инструмента и связанного с ним анализа, гомозиготность по аллелю трансгена будет продемонстрирована отсутствием аллеля дикого типа
неразрушенный аллель. К сожалению, этот подход потребует создания отдельного эндогенного клона для каждого и
каждая трансгенная линия подлежит изучению. Протоколы для определения местоположения сайта вставки трансгена на карте сцепления мыши:
обсуждается в
Раздел 7.3.2.
.


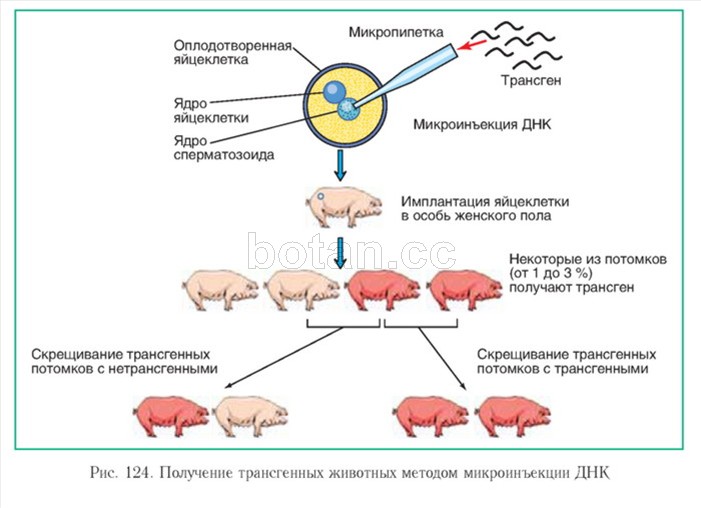 ..
..
 1925-06-23T00: 00: 00 + 0000
1925-06-23T00: 00: 00 + 0000 1985-01-01T00: 00: 00 + 0000
1985-01-01T00: 00: 00 + 0000 ), 6709-13. 1988-01-01T00: 00: 00 + 0000
), 6709-13. 1988-01-01T00: 00: 00 + 0000 Это было первое животное, получившее патентную защиту в США. 1988-04-12T00: 00: 00 + 0000
Это было первое животное, получившее патентную защиту в США. 1988-04-12T00: 00: 00 + 0000 , «Трансгенные овцы человеческого фактора IX, полученные путем переноса ядер из трансфицированных фибробластов плода», Science, 278/5346 (1997), 2130–33.1997-07-09T00: 00: 00 + 0000
, «Трансгенные овцы человеческого фактора IX, полученные путем переноса ядер из трансфицированных фибробластов плода», Science, 278/5346 (1997), 2130–33.1997-07-09T00: 00: 00 + 0000 Это было сделано путем переноса ядра взрослой клетки овцы в ядро неоплодотворенной яйцеклетки. Для достижения успеха потребовалось 277 попыток. 2003-02-14T00: 00: 00 + 0000
Это было сделано путем переноса ядра взрослой клетки овцы в ядро неоплодотворенной яйцеклетки. Для достижения успеха потребовалось 277 попыток. 2003-02-14T00: 00: 00 + 0000 Эти вирусы встроены в геномы всех свиней. Наличие таких вирусов, которые могут передавать такие заболевания, как рак, является серьезным препятствием на пути трансплантации органов свиньи человеку.Работа по редактированию генов проводилась генетиком Джорджем Черчем из Гарвардской медицинской школы. Он и его команда представили результаты Национальной академии наук США. 2015-10-05T00: 00: 00 + 0000
Эти вирусы встроены в геномы всех свиней. Наличие таких вирусов, которые могут передавать такие заболевания, как рак, является серьезным препятствием на пути трансплантации органов свиньи человеку.Работа по редактированию генов проводилась генетиком Джорджем Черчем из Гарвардской медицинской школы. Он и его команда представили результаты Национальной академии наук США. 2015-10-05T00: 00: 00 + 0000 Впервые он добился своего в 1955 году, когда изобрел электрофорез в крахмальном геле, методику, используемую для изучения изменений человеческого белка.Позже, в 1980-х годах, он разработал метод целевой замены генов у мышей, теперь известный как нацеливание на гены, за что он был удостоен Нобелевской премии по медицине в 2007 году. Его метод способствовал созданию тысяч линий мышей, несущих желаемые генетические мутации. В настоящее время таких мышей широко используют для исследования роли многих различных генов в здоровье и болезнях человека. 2017-01-10T00: 00: 00 + 0000
Впервые он добился своего в 1955 году, когда изобрел электрофорез в крахмальном геле, методику, используемую для изучения изменений человеческого белка.Позже, в 1980-х годах, он разработал метод целевой замены генов у мышей, теперь известный как нацеливание на гены, за что он был удостоен Нобелевской премии по медицине в 2007 году. Его метод способствовал созданию тысяч линий мышей, несущих желаемые генетические мутации. В настоящее время таких мышей широко используют для исследования роли многих различных генов в здоровье и болезнях человека. 2017-01-10T00: 00: 00 + 0000 цвет шерсти.Это дало возможность отслеживать частоту генетической модификации у нескольких поколений мышей. Работа опубликована в HA Grunwald et al. «Супер-менделевское наследование, опосредованное CRISPR – Cas9 в зародышевой линии самок мышей», Nature, 23 января 2019 г..2019-01-23T00: 00: 00 + 0000
цвет шерсти.Это дало возможность отслеживать частоту генетической модификации у нескольких поколений мышей. Работа опубликована в HA Grunwald et al. «Супер-менделевское наследование, опосредованное CRISPR – Cas9 в зародышевой линии самок мышей», Nature, 23 января 2019 г..2019-01-23T00: 00: 00 + 0000