Диагностика бактериального вагиноза, ДНК количественно [реал-тайм ПЦР]
Исследование, направленное на выявление генетического материала (ДНК) микроорганизмов Lactobacillus spp., Gardnerella vaginalis, Atopobium vaginae методом полимеразной цепной реакции в режиме реального времени, для диагностики бактериального вагиноза.
Синонимы русские
Бактериальный вагиноз, ДНК [полимеразная цепная реакция в режиме реального времени], количественный анализ.
Синонимы английские
Bacterial vaginosis, DNA [polymerase chain reaction, real-time PCR], quantitative, qRT-PCR.
Метод исследования
Полимеразная цепная реакция в режиме реального времени.
Единицы измерения
ГЭ/мл (геномных эквивалентов на миллилитр).
Какой биоматериал можно использовать для исследования?
Соскоб урогенитальный.
Общая информация об исследовании
Бактериальный вагиноз является патологическим процессом, возникающим преимущественно у женщин репродуктивного возраста и характеризующимся изменением состава и соотношения микрофлоры влагалища.
У здоровых женщин репродуктивного возраста общее количество микроорганизмов в вагинальном отделяемом составляет 107-109 КОЕ/мл (колониеобразующих единиц на миллилитр) и состоит из более чем 40 разнообразных видов. Преобладают палочки Додерляйна, лактобациллы (Lactobacillus spp.): L. crispatus, L. jensenii, L. acidophilus, L. brevis. Они поддерживают постоянство биохимического состава и обладают защитной функцией. Лактобациллы обладают способностью перерабатывать гликоген в молочную кислоту, продуцировать пероксид водорода, что позволяет поддерживать постоянство рН влагалища, снижая кислотность. При этом подавляется рост условно-патогенной микрофлоры. При бактериальном вагинозе отмечается дисбиоз, нарушение соотношения и увеличение роста условно-патогенных, факультативно-анаэробных, анаэробных бактерий и микоплазм. К таким микроорганизмам относятся Gardnerella vaginalis, Atopobium vaginae, Prevotella spp., Mobiluncus spp., Ureaplasma urealyticum и ряд других. Снижение количества лактобактерий и избыточный рост условно-патогенных микроорганизмов приводит к нарушениям, которые могут клинически проявиться воспалением стенок влагалища – вагинитом, сопровождающимся выраженным зудом, жжением, аномальными выделениями.
При этом подавляется рост условно-патогенной микрофлоры. При бактериальном вагинозе отмечается дисбиоз, нарушение соотношения и увеличение роста условно-патогенных, факультативно-анаэробных, анаэробных бактерий и микоплазм. К таким микроорганизмам относятся Gardnerella vaginalis, Atopobium vaginae, Prevotella spp., Mobiluncus spp., Ureaplasma urealyticum и ряд других. Снижение количества лактобактерий и избыточный рост условно-патогенных микроорганизмов приводит к нарушениям, которые могут клинически проявиться воспалением стенок влагалища – вагинитом, сопровождающимся выраженным зудом, жжением, аномальными выделениями.
Наиболее часто при бактериальном вагинозе увеличивается количество микроорганизмов: Gardnerella vaginalis, Atopobium vaginae. Gardnerella vaginalis относится к условно-патогенной микрофлоре влагалища, является факультативным анаэробом. Микроорганизмы выявляются у 95-99 % женщин с бактериальным вагинозом, в том числе при его рецидивирующем течении. Чрезмерное размножение гарднерелл приводит к вытеснению преобладающих во влагалище при норме Lactobacillus spp. и стимулирует избыточный рост анаэробных бактерий и микоплазм. Риск развития гарднереллеза увеличивают вагинальные спринцевания, использование внутриматочных контрацептивов и спиралей, хламидийная или гонококковая инфекция и т.д. Бактерия Atopobium vaginae является грамположительной анаэробной палочкой, выявляющейся у 99-100 % пациентов с бактериальным вагинозом. Она играет роль в развитии воспалительных заболеваний органов малого таза у женщин, часто обнаруживается при рецидивирующем бактериальном вагинозе. Обнаружение данных микроорганизмов играет важную роль в своевременной диагностике бактериального вагиноза, в том числе при его бессимптомном течении, предотвращении развития осложнений, а также в назначении правильной патогенетической терапии.
и стимулирует избыточный рост анаэробных бактерий и микоплазм. Риск развития гарднереллеза увеличивают вагинальные спринцевания, использование внутриматочных контрацептивов и спиралей, хламидийная или гонококковая инфекция и т.д. Бактерия Atopobium vaginae является грамположительной анаэробной палочкой, выявляющейся у 99-100 % пациентов с бактериальным вагинозом. Она играет роль в развитии воспалительных заболеваний органов малого таза у женщин, часто обнаруживается при рецидивирующем бактериальном вагинозе. Обнаружение данных микроорганизмов играет важную роль в своевременной диагностике бактериального вагиноза, в том числе при его бессимптомном течении, предотвращении развития осложнений, а также в назначении правильной патогенетической терапии.
Диагностика бактериального вагиноза основана на сочетании клинических проявлений и данных лабораторного обследования. В лабораторной диагностике является важным определение видового состава микрофлоры влагалища и определение соотношения микроорганизмов.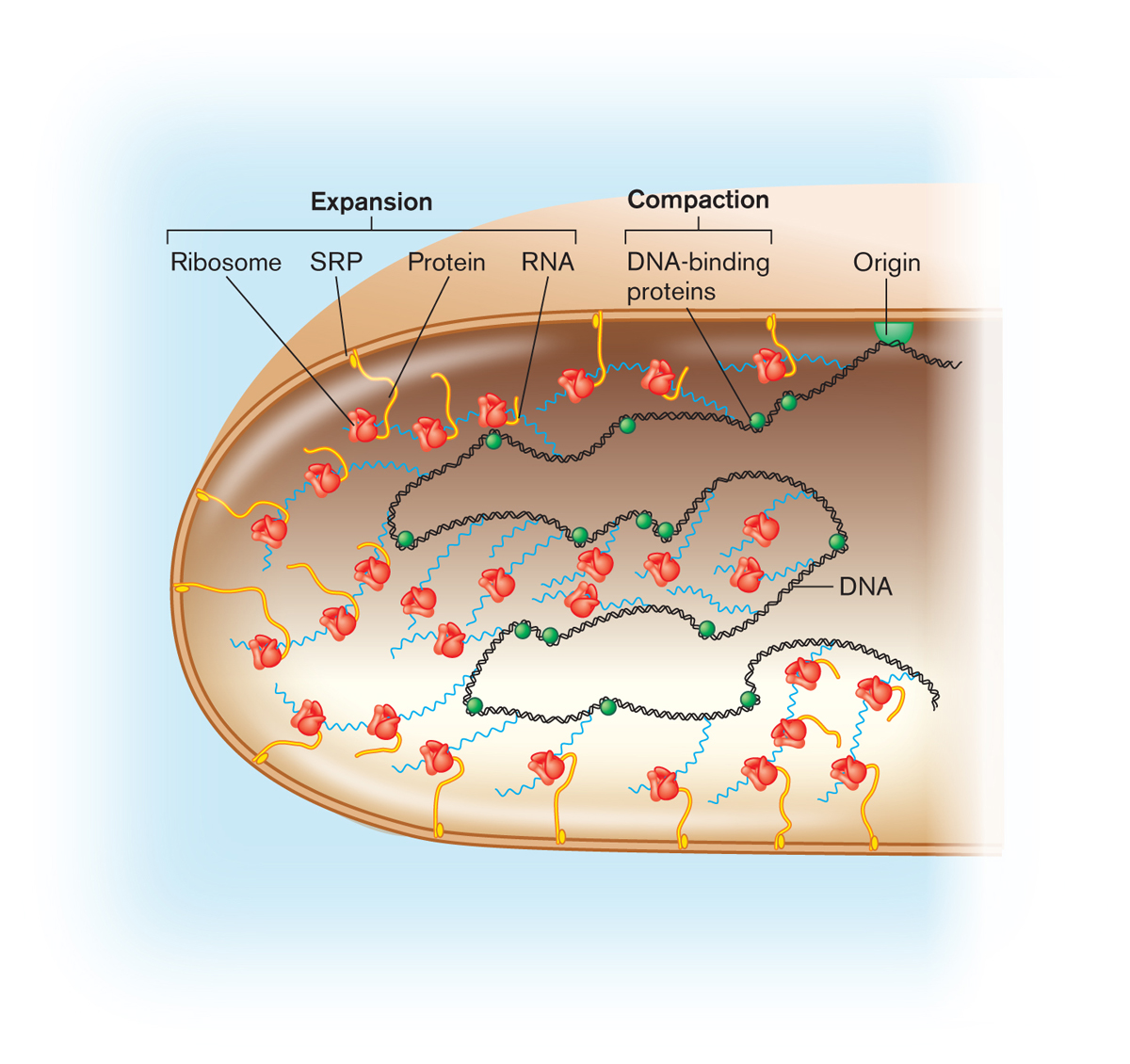 При этом определяется количество бактерий Lactobacillus spp. и других микроорганизмов.
При этом определяется количество бактерий Lactobacillus spp. и других микроорганизмов.
К современным методам диагностики относится метод полимеразной цепной реакции в режиме реального времени (РТ-ПЦР). Это метод молекулярной диагностики, позволяющий выявлять генетический материал исследуемого возбудителя. Он характеризуется высокими показателями диагностической чувствительности и специфичности, быстротой получения конечного результата. Особенностью метода является возможность выявлять ДНК (дезоксирибонуклеиновую кислоту) вируса даже при малом содержании её в исследуемом биологическом материале. Метод основан на многократном увеличении числа копий специфичного для данного возбудителя участка ДНК. При этом производится количественная оценка ДНК Bacteria (общее количество бактерий), Lactobacillus spp., Gardnerella vaginalis, Atopobium vaginae с анализом соотношения концентраций этих микроорганизмов. Метод применяется для диагностики бактериального вагиноза, в том числе при его бессимптомном течении, у женщин с патологиями беременности, с развитием воспалительных осложнений после беременности, а также при назначении и контроле проводимой терапии.
Для чего используется исследование?
- Для количественного выявления ДНК возбудителей Lactobacillus spp., Gardnerella vaginalis, Atopobium vaginae.
- Для определения соотношения количества ДНК возбудителей Lactobacillus spp., Gardnerella vaginalis, Atopobium vaginae.
- Для диагностики этиологии бактериального вагиноза и его осложнений.
- Для назначения патогенетической терапии бактериального вагиноза и для оценки контроля проводимого лечения.
Когда назначается исследование?
- При клинических проявлениях бактериального вагиноза (патологические выделения из влагалища, зуд, жжение), а также при его бессимптомном течении.
- При развитии осложнений бактериального вагиноза, патологии беременности: преждевременные роды, самопроизвольные аборты, низкий вес ребенка при рождении, развитие послеродового эндометрита, вагинита.
 6 ГЭ/мл.
6 ГЭ/мл.ДНК Lactobacillus: не менее концентрации ДНК Bacteria.
ДНК Gardnerellavaginalis: не превышает концентрацию ДНК Lactobacillus.
ДНК Atopobiumvaginae: не превышает концентрацию ДНК Lactobacillus.
Результаты выдаются с заключением врача.
Причины повышения:
- наличие ДНК микроорганизмов Lactobacillus spp., Gardnerella vaginalis, Atopobium vaginae;
- бактериальный вагиноз, вызванный нарушением соотношения возбудителей Lactobacillus spp., Gardnerella vaginalis, Atopobium vaginae.
Причины понижения:
- отсутствие бактериального вагиноза, вызванного нарушением соотношения возбудителей Lactobacillus spp., Gardnerella vaginalis, Atopobium vaginae.
Важные замечания
- При оценке результатов РТ-ПЦР выявляются фрагменты ДНК как живых, так и разрушенных микроорганизмов, поэтому результат исследования будет оставаться положительным еще в течение некоторого времени, даже если лечение было подобрано правильно.

Также рекомендуется
[09-007] Gardnerella vaginalis, ДНК [реал-тайм ПЦР]
[09-116] Анализ микробиоценоза влагалища. 16 показателей, ДНК количественно [реал-тайм ПЦР]
[09-117] Анализ микробиоценоза влагалища. 8 показателей, ДНК количественно [реал-тайм ПЦР]
[10-048] Посев на Gardnerella vaginalis с определением титра и чувствительности к противомикробным препаратам
[10-055] Исследование микробиоценоза влагалища с определением чувствительности к антибиотикам
Кто назначает исследование?
Гинеколог, акушер-гинеколог, уролог, терапевт, врач общей практики.
Литература
- Kusters JG, Reuland EA, Bouter S, Koenig P, Dorigo-Zetsma JW. A multiplex real-time PCR assay for routine diagnosis of bacterial vaginosis // Eur J Clin Microbiol Infect Dis. 2015 Sep;34(9):1779-85.
- Oakley BB, Fiedler TL, Marrazzo JM, Fredricks DN. Diversity of human vaginal bacterial communities and associations with clinically defined bacterial vaginosis // Appl Environ Microbiol.
 2008 Aug;74(15):4898-909.
2008 Aug;74(15):4898-909. - Bradshaw CS, Tabrizi SN, Fairley CK, Morton AN, Rudland E, Garland SM. The association of Atopobium vaginae and Gardnerella vaginalis with bacterial vaginosis and recurrence after oral metronidazole therapy // J Infect Dis. 2006 Sep 15;194(6):828-36.
Скрининг бактериального вагиноза — количественный
Общая характеристика
Бактериальный вагиноз (БВ) – инфекционный невоспалительный синдром, который характеризуется высокой концентрацией облигатных и факультативно – анаэробных условно-патогенных микроорганизмов при снижении/отсутствии молочнокислых, прежде всего перекись-продуцирующих, бактерий в отделяемом влагалища.
Патогенез развития бактериального вагиноза обусловлен двумя взаимосвязанными и взаимообусловленными процессами: ощелачиванием влагалищного содержимого и снижением концентрации лактобацилл.Показания для назначения
1.
 При наличии субъективных и объективных симптомов, со стороны урогенитального тракта
При наличии субъективных и объективных симптомов, со стороны урогенитального тракта
2. При отсутствии жалоб/клинических проявлений
• При длительном применении антибактериальных препаратов
• На этапе планирования беременности
• На этапе подготовки к инвазивным манипуляциям на органах малого таза
• Наличие в анамнезе бесплодия, репродуктивных потерьМаркер
Скрининговый тест для оценки вагинального биоценоза
Клиническая значимость
Данный метод позволяет в короткий срок, с высокой точностью:
• Определить количество ДНК возбудителей — основных маркеров бактериального вагиноза: Gardnerella vaginalis, Atopobium vaginae и их соотношение с Lactobacillus spp
• Выбрать правильную тактику лечения в зависимости от полученного результатаСостав показателей:
ДНК Gardnerella vaginalis, ПЦР
Метод: Полимеразная цепная реакция
Диапазон измерений: 0-0
Единица измерения: геномных эквивалентов/млРеферентные значения:
Возраст
Комментарии
ДНК Lactobacillus spp.
 , ПЦР Метод:
Полимеразная цепная реакция
, ПЦР Метод:
Полимеразная цепная реакция
Диапазон измерений: 0-0
Единица измерения: геномных эквивалентов/млРеферентные значения:
Возраст
Комментарии
ДНК Bakteria — общее количество бактерий
Метод: Полимеразная цепная реакция
Диапазон измерений: 0-0
Единица измерения: геномных эквивалентов/млРеферентные значения:
Возраст
Комментарии
ЗАКЛЮЧЕНИЕ
Диапазон измерений: 0-0
ДНК Atopobium vaginae, ПЦР
Метод: Полимеразная цепная реакция
Диапазон измерений: 0-0
Единица измерения: геномных эквивалентов/млРеферентные значения:
Возраст
Комментарии
Выполнение возможно на биоматериалах:
Биологический материал
Условия доставки
Контейнер
Объем
соскоб из заднебокового свода влагалища
Условия доставки:
24 час.
 при температуре от 2 до 8 градусов Цельсия
при температуре от 2 до 8 градусов ЦельсияКонтейнер:
Эппендорф с транспортной средой
Объем:
1.5 Миллилитров
Правила подготовки пациента
Стандартные условия подготовки (если иное не определено врачом): Воздерживаться от половых контактов 2 дня.
 Прекратить прием интравагинальных средств различного назначения (суппозитории, спермициды, спринцевания, тампоны, местные процедуры и др.). Важно: Сдавать до лечения или через 21 день после окончания антибактериальной, антимикотической терапии (если иное не определено врачом).
Прекратить прием интравагинальных средств различного назначения (суппозитории, спермициды, спринцевания, тампоны, местные процедуры и др.). Важно: Сдавать до лечения или через 21 день после окончания антибактериальной, антимикотической терапии (если иное не определено врачом).Вы можете добавить данное исследование в корзину на этой странице
Интерференция:
- Не обнаружена.

- Прием антибиотиков.
Интерпретация:
Лактобактерии, определение ДНК (Lactobаcillus spp., DNA) в соскобе эпителиальных клеток урогенитального тракта
Метод определения ПЦР с детекцией в режиме «реального времени».
Исследуемый материал Соскоб эпителиальных клеток урогенитальный
Количественное определение ДНК Lactobacillus spp. в соскобе эпителиальных клеток урогенитального тракта методом полимеразной цепной реакции (ПЦР) с детекцией в режиме «реального времени».
В настоящее время известно более 150 видов лактобацилл. В различных биотопах человека обитает около полутора-двух десятков видов. У женщин репродуктивного возраста нормофлора влагалища представлена преимущественно 5-6 видами Lactobacillus spp.
 9 КОЕ/мл, что составляет от 90 до 99,9% всей микрофлоры влагалища.
9 КОЕ/мл, что составляет от 90 до 99,9% всей микрофлоры влагалища. Лактобактерии оказывают существенное влияние на процессы обмена веществ, обеспечивают организм человека витаминами группы В, С, К, никотиновой и фолиевой кислотами, биотином, вырабатывают аминокислоты, молочную, уксусную и другие органические кислоты, антибиотико- и гормоноподобные вещества, перекись водорода, L. fermentum № 90T-C4 продуцирует эндогенный лизоцим.
Выраженный дисбиоз влагалища – состояние микробиоценоза, характеризующееся значительным снижением доли лактобактерий (менее 20% от всех выделенных микроорганизмов) или полных их отсутствием. Выявление низкого содержания лактобактерий само по себе не является основанием для заключения о наличии какого-либо заболевания, ассоциированного с нарушением состава микрофлоры, однако указывает на его высокую вероятность и требует подтверждения, основанного на результатах анализа клинических данных и/или выявления условно-патогенных бактерий в концентрации, имеющей диагностическую значимость.

Аналитические показатели:
Определяемый фрагмент — специфичный участок ДНК Lactobacillus spp.
Специфичность определения –100%.
Чувствительность определения — 100 копий ДНК Lactobacillus spp. в образце.
В тесте также проводится определение содержания общей бактериальной массы (ОБМ) и контроля взятия материала (КВМ)- тест на содержание ДНК гена HMBS человека.
ПЕРЕЧЕНЬ СПИРТОСОДЕРЖАЩИХ МЕДИЦИНСКИХ ИЗДЕЛИЙ, НА ДЕЯТЕЛЬНОСТЬ ПО ПРОИЗВОДСТВУ, ИЗГОТОВЛЕНИЮ И (ИЛИ) ОБОРОТУ КОТОРЫХ НЕ РАСПРОСТРАНЯЕТСЯ ДЕЙСТВИЕ ФЕДЕРАЛЬНОГО ЗАКОНА «О ГОСУДАРСТВЕННОМ РЕГУЛИРОВАНИИ ПРОИЗВОДСТВА И ОБОРОТА ЭТИЛОВОГО СПИРТА, АЛКОГОЛЬНОЙ И СПИРТОСОДЕРЖАЩЕЙ ПРОДУКЦИИ И ОБ ОГРАНИЧЕНИИ ПОТРЕБЛЕНИЯ (РАСПИТИЯ) АЛКОГОЛЬНОЙ ПРОДУКЦИИ»
Номер регистрационного удостоверения на медицинское изделие
Наименование медицинского изделия с указанием варианта исполнения (модели)
Производитель (изготовитель) медицинского изделия
1.

ФСЗ 2011/10311 от 02.08.2011
реагенты для окраски мазков из клинически исследуемого материала, вариант исполнения Color Gram 2, R4 — Сафранин краситель
«биоМерье С.А.», Французская Республика
2.
ФСЗ 2011/10311 от 02.08.2011
реагенты для окраски мазков из клинически исследуемого материала, вариант исполнения Color Gram 2, R1 — Кристаллический фиолетовый краситель
«биоМерье С.А.», Французская Республика
3.
РЗН 2015/3503 от 27.03.2019
комплект реагентов для экстракции ДНК из биологического материала «АмплиСенс(R) ДНК-сорб-Д»
по ТУ 9398-233-01897593-2015, вариант исполнения форма 1
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Российская Федерация
4.

РЗН 2016/4228 от 17.04.2019
набор реагентов для диагностики in vitro АмплиСенс(R) HBV-Resist-Seq
по ТУ 9398-222-01897593-2014, вариант исполнения форма 1
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Российская Федерация
5.
РЗН 2016/3920 от 18.04.2019
комплект реагентов для экстракции ДНК из биологического материала «АмплиСенс(R) МАГНО-сорб-УРО»
по ТУ 9398-218-01897593-2015, вариант исполнения форма 1
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Российская Федерация
6.
ФСР 2010/07265 от 09.04.2019
комплект реагентов для выделения РНК/ДНК из клинического материала «МАГНО-сорб»
по ТУ 9398-106-01897593-2012, вариант исполнения форма 2
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Российская Федерация
7.

ФСР 2010/07265 от 09.04.2019
комплект реагентов для выделения РНК/ДНК из клинического материала «МАГНО-сорб»
по ТУ 9398-106-01897593-2012, вариант исполнения форма 1
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Российская Федерация
8.
ФСР 2009/06189 от 25.02.2019
набор реагентов для выявления аллели 5701 локуса В главного комплекса гистосовместимости человека (HLA B*5701) в клиническом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией в режиме «реального времени» «АмплиСенс(R) Геноскрин HLA B*5701-FL»
по ТУ 9398-099-01897593-2009, вариант исполнения форма 1
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Российская Федерация
9.

ФСР 2009/06187 от 26.02.2019
набор реагентов для одновременного выявления РНК вируса гепатита C (HCV), ДНК вируса гепатита B (HBV) и РНК вируса иммунодефицита человека (HIV) в клиническом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией «АмплиСенс(R) HCV/HBV/HIV-FL»
по ТУ 9398-069-01897593-2012, вариант исполнения форма 3
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Российская Федерация
10.
ФСР 2007/00183 от 04.03.2019
комплект реагентов для выделения ДНК из клинического материала «ДНК-сорб-АМ» по ТУ 9398-036-01897593-2009, вариант исполнения форма 2
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Российская Федерация
11.

ФСР 2007/00579 от 27.02.2019
набор реагентов для выявления и количественного определения мРНК химерного гена bcr-abl (вариант М-bcr) и мРНК гена abl в клиническом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией в режиме «реального времени» «АмплиСенс(R) Лейкоз Квант M-bcr-FRT»
по ТУ 9398-033-01897593-2007, вариант исполнения форма 1
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Российская Федерация
12.
ФСР 2009/05365 от 22.03.2019
набор реагентов для определения рРНК Chlamydia trachomatis в клиническом материале с помощью реакции транскрипционной амплификации (НАСБА) в режиме «реального времени» для диагностики in vitro «АмплиСенс(R) Chlamydia trachomatis-РИБОТЕСТ» по ТУ 9398-016-01897593-2009, вариант исполнения форма 1
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Российская Федерация
13.

ФСР 2009/06301 от 27.03.2019
набор реагентов для определения рРНК Neisseria gonorrhoeae в клиническом материале с помощью реакции транскрипционной амплификации (НАСБА) в режиме «реального времени» для диагностики in vitro «АмплиСенс(R) Neisseria gonorrhoeae-РИБОТЕСТ» по ТУ 9398-017-01897593-2009, вариант исполнения форма 1
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Российская Федерация
14.
ФСР 2008/02414 от 27.02.2019
набор реагентов для определения тропизма и выявления мутаций устойчивости вируса иммунодефицита человека (ВИЧ-1) к антиретровирусным препаратам в клиническом материале методом полимеразной цепной реакции (ПЦР) с последующим секвенированием продуктов амплификации «АмплиСенс(R) HIV-Resist-Seq»
по ТУ 9398-013-01897593-2011, вариант исполнения форма 5
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Российская Федерация
15.

ФСР 2008/02414 от 27.02.2019
набор реагентов для определения тропизма и выявления мутаций устойчивости вируса иммунодефицита человека (ВИЧ-1) к антиретровирусным препаратам в клиническом материале методом полимеразной цепной реакции (ПЦР) с последующим секвенированием продуктов амплификации «АмплиСенс(R) HIV-Resist-Seq»
по ТУ 9398-013-01897593-2011, вариант исполнения форма 1
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Российская Федерация
16.
ФСР 2008/02552 от 22.11.2019
набор реагентов для количественного определения РНК вируса иммунодефицита человека типа 1 (ВИЧ-1) в клиническом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией «АмплиСенс(R) ВИЧ-Монитор-FRT»
по ТУ 9398-008-01897593-2012, вариант исполнения форма 4
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Российская Федерация
17.

ФСР 2008/02552 от 22.11.2019
набор реагентов для количественного определения РНК вируса иммунодефицита человека типа 1 (ВИЧ-1) в клиническом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией «АмплиСенс(R) ВИЧ-Монитор-FRT»
по ТУ 9398-008-01897593-2012, вариант исполнения форма 1
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Российская Федерация
18.
ФСР 2008/03993 от 22.02.2019
комплект реагентов для выделения РНК/ДНК из клинического материала «РИБО-сорб»
по ТУ 9398-004-01897593-2008, вариант исполнения форма 2
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Российская Федерация
19.

ФСР 2008/03993 от 22.02.2019
комплект реагентов для выделения РНК/ДНК из клинического материала «РИБО-сорб»
по ТУ 9398-004-01897593-2008, вариант исполнения форма 1
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Российская Федерация
20.
ФСР 2012/14099 от 17.03.2017
набор реагентов для выявления и количественного определения РНК вируса иммунодефицита человека методом ОТ-ПЦР в режиме реального времени (РеалБест РНК ВИЧ количественный)
по ТУ 9398-360-23548172-2012
акционерное общество «Вектор-Бест»,
Российская Федерация
21.
ФСР 2012/14103 от 23.03.2017
набор реагентов для выявления ДНК вируса гепатита B методом полимеразной цепной реакции в режиме реального времени (РеалБест ДНК ВГВ)
по ТУ 9398-361-23548172-2012
акционерное общество «Вектор-Бест»,
Российская Федерация
22.

РЗН 2014/1423 от 25.03.2017
набор реагентов для выделения нуклеиновых кислот из клинических образцов (РеалБест экстракция 100)
по ТУ 9398-464-23548172-2013
акционерное общество «Вектор-Бест»,
Российская Федерация
23.
РЗН 2017/5872 от 26.06.2017
набор реагентов для выделения ДНК из клинических образцов (Лизирующий раствор)
по ТУ 9398-551-23548172-2016
акционерное общество «Вектор-Бест»,
Российская Федерация
24.
РЗН 2017/5985 от 19.07.2017
набор реагентов для автоматического выделения нуклеиновых кислот из клинических образцов (РеалБест УниМаг)
по ТУ 9398-545-23548172-2016
акционерное общество «Вектор-Бест»,
Российская Федерация
25.
ФСР 2010/06867 от 03.04.2017
набор реагентов для выделения нуклеиновых кислот из сыворотки (плазмы) крови (РеалБест экстракция 1000) по ТУ 9398-210-23548172-2009
акционерное общество «Вектор-Бест»,
Российская Федерация
26.

ФСР 2012/14098 от 17.03.2017
набор реагентов для выявления РНК вируса иммунодефицита человека методом ОТ-ПЦР в режиме реального времени (РеалБест РНК ВИЧ)
по ТУ 9398-359-23548172-2012
акционерное общество «Вектор-Бест»,
Российская Федерация
27.
ФСР 2012/14101 от 20.03.2017
набор реагентов для выявления РНК вируса гепатита C методом ОТ-ПЦР в режиме реального времени (РеалБест РНК ВГС)
по ТУ 9398-356-23548172-2012
акционерное общество «Вектор-Бест»,
Российская Федерация
28.
ФСР 2012/14102 от 21.03.2017
набор реагентов для выявления и количественного определения РНК вируса гепатита C методом ОТ-ПЦР в режиме реального времени (РеалБест РНК ВГС количественный)
по ТУ 9398-355-23548172-2012
акционерное общество «Вектор-Бест»,
Российская Федерация
29.

РЗН 2017/6191 от 04.09.2017
набор реагентов для выявления провирусной ДНК вируса иммунодефицита человека (ВИЧ-1) методом полимеразной цепной реакции в режиме реального времени (РеалБест ДНК ВИЧ) по ТУ 9398-535-23548172-2016
акционерное общество «Вектор-Бест»,
Российская Федерация
30.
ФСР 2012/13148 от 18.05.2017
набор реагентов для выделения ДНК из клинических образцов (РеалБест ДНК-экстракция 2)
по ТУ 9398-279-23548172-2011
акционерное общество «Вектор-Бест»,
Российская Федерация
31.
ФСР 2012/14104 от 25.03.2017
набор реагентов для выявления и количественного определения ДНК вируса гепатита B методом полимеразной цепной реакции в режиме реального времени (РеалБест ДНК ВГВ количественный)
по ТУ 9398-362-23548172-2012
акционерное общество «Вектор-Бест»,
Российская Федерация
32.

РЗН 2013/1276 от 29.03.2017
набор реагентов для выделения ДНК из клинических образцов (РеалБест ДНК-экстракция 1)
по ТУ 9398-411-23548172-2013
акционерное общество «Вектор-Бест»,
Российская Федерация
33.
РЗН 2017/5873 от 26.06.2017
набор реагентов для выделения ДНК из клинических образцов (РеалБест ДНК-экстракция 3)
по ТУ 9398-590-23548172-2016
акционерное общество «Вектор-Бест»,
Российская Федерация
34.
РЗН 2017/6051 от 04.08.2017
набор реагентов для выявления ДНК микобактерий туберкулезного комплекса методом полимеразной цепной реакции в режиме реального времени (РеалБест ДНК МВТС)
по ТУ 9398-549-23548172-2016
акционерное общество «Вектор-Бест»,
Российская Федерация
35.
ФСР 2009/04160 от 11.
 01.2016
01.2016набор реагентов для окраски по Граму «Диахим-Набор для окраски по Граму»
по ТУ 9398-019-27428909-2008
общество с ограниченной ответственностью «Научно-производственная фирма «АБРИС+», Российская Федерация
36.
РЗН 2018/7102 от 22.06.2020
набор реагентов для окраски гинекологических мазков по Папаниколау «МЛТ-ПАП-ДИФФ» по ТУ 21.20.23-001-23475651-2017, вариант исполнения комплектация 3
общество с ограниченной ответственностью МЛТ, Российская Федерация
37.
ФСР 2011/10540 от 11.10.2016
комплект реагентов для окраски микроорганизмов по методу Циль-Нильсена (Микро-ЦИЛЬ-НИЛЬСЕН-НИЦФ)
по ТУ-9398-003-39484474-2002
общество с ограниченной ответственностью «Научно-исследовательский центр фармакотерапии», Российская Федерация
38.
ФСР 2011/10541 от 11.
 10.2016
10.2016комплект реагентов для окраски микроорганизмов по методу Грама (Микро-ГРАМ-НИЦФ)
по ТУ 9398-002-39484474-2002
общество с ограниченной ответственностью «Научно-исследовательский центр фармакотерапии», Российская Федерация
39.
ФСР 2011/10542 от 15.11.2016
комплект реагентов для окраски микроорганизмов по методу Нейссера (Микро-НЕЙССЕР-НИЦФ)
по ТУ 9398-004-39484474-2002
общество с ограниченной ответственностью «Научно-исследовательский центр фармакотерапии», Российская Федерация
40.
РЗН 2013/1134 от 11.10.2016
набор реагентов для определения бактериальной декарбоксилазной активности по ТУ 9398-011-39484474-2012, варианты исполнения «Микро-АРГИНИН-НИЦФ», «Микро-ЛИЗИН-НИЦФ», «Микро-ОРНИТИН-НИЦФ»
общество с ограниченной ответственностью «Научно-исследовательский центр фармакотерапии», Российская Федерация
41.

РЗН 2020/10087 от 19.06.2020
набор реагентов для выделения РНК вируса SARS-CoV-2 из биологического материала в вариантах исполнения по ТУ 21.10.60-002-06931260-2020, вариант исполнения I. 24 определения, вариант исполнения II. 96 определений
общество с ограниченной ответственностью «ЭВОТЭК-МИРАЙ ГЕНОМИКС»,
Российская Федерация
42.
РЗН 2015/3321 от 23 ноября 2015 г.
наборы реагентов для подготовки образцов с целью последующего анализа методом MALDI-TOF на масс-спектрометре VITEK MS, вариант исполнения набор реагентов для пробоподготовки Матрикс VITEK MS-CHCA
«биоМерье С.А.»,
Французская Республика
43.
ФСЗ 2010/07881 от 10 сентября 2010 г.
реагенты к прибору PREVI Color Gram для автоматического окрашивания по Граму клинических образцов, вариант исполнения PREVI Color Gram CRYSTAL VIOLET SOLUTION — Кристаллического фиолетового раствор
«биоМерье С.
 А.»,
А.»,Французская Республика
44.
ФСЗ 2011/10309 от 2 августа 2011 г.
реагенты (реактивы) для идентификации микроорганизмов и определения чувствительности к антимикробным препаратам, вариант исполнения VP 1 + VP 2 — реактивы VP 1 и VP 2
«биоМерье С.А.»,
Французская Республика
45.
ФСЗ 2011/10309 от 2 августа 2011 г.
реагенты (реактивы) для идентификации микроорганизмов и определения чувствительности к антимикробным препаратам, вариант исполнения EHR — реактив EHR
«биоМерье С.А.»,
Французская Республика
46.
ФСЗ 2011/10309 от 2 августа 2011 г.
реагенты (реактивы) для идентификации микроорганизмов и определения чувствительности к антимикробным препаратам, вариант исполнения VP A + VP B — реактивы VP A и VP B
«биоМерье С.
 А.»,
А.»,Французская Республика
47.
ФСЗ 2011/10444 от 6 сентября 2011 г.
наборы лабораторных реагентов для in vitro диагностики к автоматическим станциям QIAGEN, вариант исполнения: набор лабораторных реагентов для выделения ДНК EZ1 DNA Blood 200 ul Kit (48) на 48 образцов, в составе: картриджи для реагентов — 48 шт.; наконечники одноразовые — 50 шт.; держатели для наконечников — 50 шт.; пробирки для образцов — 50 шт.; пробирки для элюента — 50 шт.; инструкция — 1 шт.; карта со штрих-кодом — 1 шт.
«КИАГЕН ГмбХ»,
Федеративная Республика Германия
48.
ФСЗ 2011/10444 от 6 сентября 2011 г.
наборы лабораторных реагентов для in vitro диагностики к автоматическим станциям QIAGEN, вариант исполнения: набор лабораторных реагентов для выделения ДНК EZ1 DNA Blood 350 ul Kit (48) на 48 образцов, в составе: картриджи для реагентов — 48 шт.
 ; наконечники одноразовые — 50 шт.; держатели для наконечников — 50 шт.; пробирки для образцов — 50 шт.; пробирки для элюента — 50 шт.; инструкция — 1 шт.; карта со штрих — кодом — 1 шт.; пробирка с буфером G2 — 1 шт.; пробирки с протеиназой К — 2 шт.; пробирка с переносчиком РНК — 1 шт.
; наконечники одноразовые — 50 шт.; держатели для наконечников — 50 шт.; пробирки для образцов — 50 шт.; пробирки для элюента — 50 шт.; инструкция — 1 шт.; карта со штрих — кодом — 1 шт.; пробирка с буфером G2 — 1 шт.; пробирки с протеиназой К — 2 шт.; пробирка с переносчиком РНК — 1 шт.«КИАГЕН ГмбХ»,
Федеративная Республика Германия
49.
ФСЗ 2011/10444 от 6 сентября 2011 г.
наборы лабораторных реагентов для in vitro диагностики к автоматическим станциям QIAGEN, вариант исполнения: набор лабораторных реагентов для выделения ДНК EZ1 DNA Investigator Kit (48) на 48 образцов, в составе: картриджи для реагентов — 48 шт.; наконечники одноразовые — 100 шт.; держатели для наконечников — 100 шт.; пробирки для образцов — 50 шт.; пробирки для элюента — 50 шт.; инструкция — 1 шт.; карта со штрих-кодом — 1 шт.; пробирка с реагентом QIAzol — 1 шт.
«КИАГЕН ГмбХ»,
Федеративная Республика Германия
50.

ФСЗ 2011/10444 от 6 сентября 2011 г.
наборы лабораторных реагентов для in vitro диагностики к автоматическим станциям QIAGEN, вариант исполнения: набор лабораторных реагентов для выделения вирусных нуклеиновых кислот или бактериальной ДНК QIAsymphony Virus/Bacteria Midi Kit (96) на 96 образцов, в составе: картриджи для реагентов — 2 шт.; штативы с ферментами — 2 шт.; прокалывающие крышки — 2 шт.; буферы AVE — 2 пробирки; буферы AVE — 2 флакона; пленки многоразовые — 2 упаковки; переносчики РНК — 2 пробирки
«КИАГЕН ГмбХ»,
Федеративная Республика Германия
51.
ФСЗ 2011/10444 от 6 сентября 2011 г.
наборы лабораторных реагентов для in vitro диагностики к автоматическим станциям QIAGEN, вариант исполнения: набор лабораторных реагентов для выделения вирусных нуклеиновых кислот или бактериальной ДНК QIAsymphony Virus/Bacteria Mini Kit (192) на 192 образца, в составе: картриджи для реагентов — 2 шт.
 ; штативы с ферментами — 2 шт.; прокалывающие крышки — 2 шт.; буферы AVE — 2 пробирки; буферы AVE — 2 флакона; пленки многоразовые — 2 упаковки; переносчики РНК — 2 пробирки
; штативы с ферментами — 2 шт.; прокалывающие крышки — 2 шт.; буферы AVE — 2 пробирки; буферы AVE — 2 флакона; пленки многоразовые — 2 упаковки; переносчики РНК — 2 пробирки«КИАГЕН ГмбХ»,
Федеративная Республика Германия
52.
ФСЗ 2011/10444 от 6 сентября 2011 г.
наборы лабораторных реагентов для in vitro диагностики к автоматическим станциям QIAGEN, вариант исполнения: набор лабораторных реагентов для выделения ДНК QIAsymphony DNA Midi Kit (96) на 96 образцов, в составе: картриджи для реагентов — 2 шт.; штативы с ферментами — 2 шт.; прокалывающие крышки — 2 шт.; буфер ATE — 1 флакон; пленки многоразовые — 2 упаковки
«КИАГЕН ГмбХ»,
Федеративная Республика Германия
53.
ФСЗ 2011/10444 от 6 сентября 2011 г.
наборы лабораторных реагентов для in vitro диагностики к автоматическим станциям QIAGEN, вариант исполнения: набор лабораторных реагентов для выделения ДНК QIAsymphony DNA Mini Kit (192) на 192 образца, в составе: картриджи для реагентов — 2 шт.
 ; штативы с ферментами — 2 шт.; прокалывающие крышки — 2 шт.; буфер ATE — 1 флакон; пленки многоразовые — 2 упаковки
; штативы с ферментами — 2 шт.; прокалывающие крышки — 2 шт.; буфер ATE — 1 флакон; пленки многоразовые — 2 упаковки«КИАГЕН ГмбХ»,
Федеративная Республика Германия
54.
ФСЗ 2008/01284 от 14 августа 2017 г.
материалы для ортодонтии, вариант исполнения Трансбонд MIP Моисче Инсенситив Праймер (Transbond MIP Moisture Insensitive Primer)
«3М Юнитек Корпорейшн»,
Соединенные Штаты Америки
55.
ФСЗ 2010/06859 от 2 июня 2017 г.
материал стеклоиономерный пломбировочный Vitremer в наборах и в отдельных упаковках, с принадлежностями: Праймер
«3М ЭСПЭ Дентал Продактс»,
Соединенные Штаты Америки
56.
РЗН 2017/5981 от 19 июля 2017 г.
адгезив стоматологический Single Bond Universal в отдельных упаковках
«3М Дойчланд ГмбХ»,
Федеративная Республика Германия
57.

ФСЗ 2012/11540 от 1 декабря 2017 г.
материал стоматологический фторсодержащий Clinpro White Varnish в наборах
«3М ЭСПЭ Дентал Продактс»,
Соединенные Штаты Америки
58.
ФСЗ 2009/05271 от 8 июня 2017 г.
адгезив стоматологический Adper Single Bond 2 во флаконе
«3М ЭСПЕ Дентал Продактс»,
Соединенные Штаты Америки
59.
ФСЗ 2009/05270 от 11 апреля 2017 г.
адгезив стоматологический Adper Easy One
«3М Дойчланд ГмбХ»,
Федеративная Республика Германия
60.
ФСР 2010/07306 от 9 апреля 2019 г.
набор реагентов для определения рРНК Mycoplasma genitalium в клиническом материале с помощью реакции транскрипционной амплификации (НАСБА) в режиме «реального времени» для диагностики in vitro «АмплиСенс(R) Mycoplasma genitalium-РИБОТЕСТ»
по ТУ 9398-079-01897593-2009, вариант исполнения форма 1
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека,
Российская Федерация
61.

ФСР 2010/07305 от 27 марта 2019 г.
набор реагентов для определения рРНК Trichomonas vaginalis в клиническом материале с помощью реакции транскрипционной амплификации (НАСБА) в режиме «реального времени» для диагностики in vitro «АмплиСенс(R) Trichomonas vaginalis-РИБОТЕСТ»
по ТУ 9398-078-01897593-2009, вариант исполнения форма 1
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека,
Российская Федерация
62.
ФСР 2008/03147 от 22 февраля 2019 г.
комплект реагентов для выделения РНК/ДНК из клинического материала «РИБО-преп»
по ТУ 9398-071-01897593-2008, вариант исполнения форма 2
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека,
Российская Федерация
63.

ФСР 2007/00577 от 27 декабря 2019 г.
набор реагентов для количественного определения РНК вируса гепатита C (HCV) в клиническом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией в режиме «реального времени» «АмплиСенс(R) HCV-Монитор-FL»
по ТУ 9398-035-01897593-2012, вариант исполнения форма 4
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека,
Российская Федерация
64.
ФСР 2007/00577 от 27 декабря 2019 г.
набор реагентов для количественного определения РНК вируса гепатита C (HCV) в клиническом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией в режиме «реального времени» «АмплиСенс(R) HCV-Монитор-FL»
по ТУ 9398-035-01897593-2012, вариант исполнения форма 2
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека,
Российская Федерация
65.

ФСР 2007/00577 от 27 декабря 2019 г.
набор реагентов для количественного определения РНК вируса гепатита C (HCV) в клиническом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией в режиме «реального времени» «АмплиСенс(R) HCV-Монитор-FL»
по ТУ 9398-035-01897593-2012, вариант исполнения форма 1
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека,
Российская Федерация
66.
ФСР 2007/00584 от 27 августа 2019 г.
набор реагентов для количественного определения ДНК вируса гепатита B (HBV) в клиническом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией в режиме «реального времени» «АмплиСенс(R) HBV-Монитор-FL»
по ТУ 9398-031-01897593-2012, вариант исполнения форма 4
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека,
Российская Федерация
67.

ФСР 2007/00584 от 27 августа 2019 г.
набор реагентов для количественного определения ДНК вируса гепатита B (HBV) в клиническом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией в режиме «реального времени» «АмплиСенс(R) HBV-Монитор-FL»
по ТУ 9398-031-01897593-2012, вариант исполнения форма 2
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека,
Российская Федерация
68.
ФСР 2007/00584 от 27 августа 2019 г.
набор реагентов для количественного определения ДНК вируса гепатита B (HBV) в клиническом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией в режиме «реального времени» «АмплиСенс(R) HBV-Монитор-FL»
по ТУ 9398-031-01897593-2012, вариант исполнения форма 1
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека,
Российская Федерация
69.

ФСР 2008/02552 от 22 ноября 2019 г.
набор реагентов для количественного определения РНК вируса иммунодефицита человека типа 1 (ВИЧ-1) в клиническом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией «АмплиСенс(R) ВИЧ-Монитор-FRT»
по ТУ 9398-008-01897593-2012, вариант исполнения форма 2
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека,
Российская Федерация
70.
ФСР 2011/10234 от 27 февраля 2019 г.
набор реагентов для выявления провирусной ДНК вируса иммунодефицита человека (ВИЧ-1) в клиническом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией «АмплиСенс(R) ДНК-ВИЧ-FL»
по ТУ 9398-007-01897593-2012, вариант исполнения форма 3
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека,
Российская Федерация
71.

ФСР 2011/10234 от 27 февраля 2019 г.
набор реагентов для выявления провирусной ДНК вируса иммунодефицита человека (ВИЧ-1) в клиническом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией «АмплиСенс(R) ДНК-ВИЧ-FL»
по ТУ 9398-007-01897593-2012, вариант исполнения форма 2
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека,
Российская Федерация
72.
ФСР 2011/10234 от 27 февраля 2019 г.
набор реагентов для выявления провирусной ДНК вируса иммунодефицита человека (ВИЧ-1) в клиническом материале методом полимеразной цепной реакции
(ПЦР) с гибридизационно-флуоресцентной детекцией «АмплиСенс(R) ДНК-ВИЧ-FL»
по ТУ 9398-007-01897593-2012, вариант исполнения форма 1
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии»
Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека,
Российская Федерация
73.

ФСР 2009/05220 от 5 марта 2019 г.
комплект реагентов для выделения ДНК из клинического материала «ДНК-сорб-В»
по ТУ 9398-003-01897593-2009, вариант исполнения форма 2
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека,
Российская Федерация
74.
ФСР 2008/02417 от 13 марта 2019 г.
набор реагентов для выявления ДНК Bacillus anthracis в биологическом материале и объектах окружающей среды методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией в режиме «реального времени» «АмплиСенс(R) Bacillus anthracis-FRT»
по ТУ 9398-001-01897593-2007, вариант исполнения форма 1
федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека,
Российская Федерация
75.

ФСР 2012/13860 от 25 января 2016 г.
набор реагентов для исследования на гельминты по Рабиновичу («ДИАХИМ-Набор реагентов для исследования на гельминты по Рабиновичу»)
по ТУ 9398-060-27428909-2012
общество с ограниченной ответственностью «Научно-производственная фирма «АБРИС+»,
Российская Федерация
76.
ФСР 2009/04171 от 30 декабря 2015 г.
набор реагентов для окраски по Циль-Нильсену «Диахим-Набор для окраски
по Циль-Нильсену»
по ТУ 9398-020-27428909-2008
общество с ограниченной ответственностью «Научно-производственная фирма «АБРИС+»,
Российская Федерация
77.
ФСР 2010/07196 от 29 января 2016 г.
набор реагентов для клинического анализа мокроты («Диахим-Набор реагентов для клинического анализа мокроты»)
по ТУ 9398-032-27428909-2009
общество с ограниченной ответственностью «Научно-производственная фирма «АБРИС+»,
Российская Федерация
78.

ФСР 2010/07198 от 22 января 2016 г.
набор реагентов для клинического анализа кала («Диахим-Набор реагентов для клинического анализа кала»)
по ТУ 9398-033-27428909-2009
общество с ограниченной ответственностью «Научно-производственная фирма «АБРИС+»,
Российская Федерация
79.
ФСР 2012/14188 от 22 января 2016 г.
набор реагентов для клинического анализа мочи (ДИАХИМ-КЛИНИКА МОЧА)
по ТУ 9398-065-27428909-2012
общество с ограниченной ответственностью «Научно-производственная фирма «АБРИС+»,
Российская Федерация
80.
РЗН 2020/9754 от 10 марта 2020 г.
средство от запотевания ULTRASTOP, в вариантах исполнения:
Средство от запотевания ULTRASTOP, спрей, 15 мл; Средство от запотевания ULTRASTOP, флакон с пипеткой, 25 мл
МоНо хем-фарм Продуктэ ГмбХ,
Австрийская Республика
81.

РЗН 2019/8238 от 26 марта 2019 г.
покрытие дентальное для уменьшения чувствительности зубов Enamelast(R) с принадлежностями
«Ультрадент Продактс, Инк.»,
Соединенные Штаты Америки
82.
РЗН 2016/4200 от 26 марта 2018 г.
светоотверждаемый однокомпонентный адгезивный материал GLUMA Bond 5
«Кульцер ГмбХ»,
Федеративная Республика Германия
83.
РЗН 2013/533 от 11 июня 2013 г.
материалы стоматологические фиксирующие Ultradent в наборах, вариант исполнения набор Peak Universal Bond Self-Etch Kit
«Ультрадент Продактс, Инк.»,
Соединенные Штаты Америки
84.
ФСЗ 2010/08152 от 20 мая 2019 г.
материал светоотверждаемый однокомпонентный адгезивный GLUMA(R) в наборах и отдельных упаковках, вариант исполнения набор GLUMA(R) 2Bond Bottle Refill
«Кульцер ГмбХ»,
Федеративная Республика Германия
85.

РЗН 2019/9471 от 26 декабря 2019 г.
материал стоматологический универсальный адгезивный однокомпонентный светоотверждаемый OptiBond Universal
«Керр Корпорэйшн»,
Соединенные Штаты Америки
Ведение беременности в клинике «Поликлиника.ру»
Наименование услуги 1 триместр 2 триместр 3 триместр Прием врача акушера-гинеколога 3 4 7 Прием врача терапевта 1 1 1 Консультация врача офтальмолога 1 — 1 Консультация ЛОРа 1 — 1 Консультация врача — эндокринолога 1 — — Консультация врача — стоматолога 1 1 1 ЭКГ 1 — 1 Ультразвуковая диагностика 1 2 1 Курация профессора (аудит проводимых исследований Шеховцов Д.  Б.)
Б.)1 2 1 Допплерография плода — — 1 Кардиотокография (КТГ) — — 1 Врачебный патронаж новорождённого на дому в пределах МКАД (в подарок 1 визит доктора)
— — 1 Клинико-лабораторные исследования: Женский мазок из 2-х точек 1 1 1 Мазок на онкоцитологию
(2 препарата)1 — — Расширенный флороценоз + ЗППП
( ДНК Candida albicans, ДНК Candida glablata, ДНК Candida krusei, ДНК Candida parapsilosis, ДНК Candida tropicalis, ДНК Ureaplasma urealyticum, ДНК Mycoplasma hominis, ДНК Gardnerella vaginalis, ДНК Atopobium vaginae, ДНК Enterobacteriaceae, ДНК Staphylococcus spp, ДНК Streptococcus spp, ДНК Lactobacillus spp, ДНК Bacteria spp, TCMT(кол): ДНК Neisseria gonorrhoeae, ДНК Chlamydia trahomatis, ДНК Mycoplasma genitalium, ДНК Trichomonas vaginalis (кол. ))
))1 — — Общий анализ крови + СОЭ
с лейкоцитарной формулой
(гемоглобин, гематокрит, эритроциты, лейкоциты, тромбоциты, эритроцитарные индексы — МСV, MCH, MCHC)2 2 4 Общий анализ мочи с микроскопией
осадка3 4 7 anti-HSV 1 типа IgG
(вирус простого герпеса)1 — — anti-HSV 2 типа IgG
(вирус простого герпеса)1 — — anti-HSV 1, 2 типа IgM
(вирус простого герпеса)1 — — anti-CMV IgG
(анализ крови на цитомегаловирус)1 — — anti-CMV IgM
(анализ крови на цитомегаловирус)1 — — anti-Rubella IgG
(анализ крови на краснуху)1 — — anti-Rubella IgM
(анализ крови на краснуху)1 — — anti-Toxo gondii IgG
(анализ крови на токсоплазмоз)1 — — anti-Toxo gondii IgM
(анализ крови на токсоплазмоз)1 — — HBsAg, anti-HCV IgG (кровь на гепатит) 1 — 1 Syphilis RPR (RW) (анализ крови на RW) 1 1 1 anti-HIV 1/2 (кровь (анализ крови на ВИЧ) 1 — 1 Группа крови + Rh фактор 1 — — Исследование на бета-гемолитический стрептококк группы В ( Streptococcus agalactiae), антигенный тест — — 1 Пренатальный скрининг трисомий 1 триместра по международной системе Астрайя (Astraia) (FMF) 1 — — PAPP-A (Ассоциированный с беременностью протеин-А плазмы, ПАПП-А)( сыворотка крови), свободная b-субъединица хорионического гонадотропина человека (свободный b-ХГЧ, free b-HCG)( сыворотка крови) 1 — — Пренатальный скрининг трисомий: 1 триместр (PRISСA-1)( сыворотка крови) 1 — — Биохимический анализ крови
(общий белок, креатинин, мочевина,
билирубин общий, билирубин прямой,
АСТ, АЛТ)1 — 1 Посев на флору с определением чувствительности к расширенному спектру антибиотиков 2 — — Кардиотокография (КТГ) — — 1 Глюкоза (анализ крови) 1 1 1 Глюкозотолерантный тест) — 1 — Гормоны щитовидной железы
(Т4 свободный, ТТГ)1 — — Расширенный флороценоз+ЗППП: 506403 Флороценоз и ЗППП( ДНК Candida albicans, ДНК Candida glablata, ДНК Candida krusei, ДНК Candida parapsilosis, ДНК Candida tropicalis, ДНК Ureaplasma urealyticum, ДНК Mycoplasma hominis, ДНК Gardnerella vaginalis, ДНК Atopobium vaginae, ДНК Enterobacteriaceae, ДНК Staphylococcus spp, ДНК Streptococcus spp, ДНК Lactobacillus spp, ДНК Bacteria spp, TCMT(кол): ДНК Neisseria gonorrhoeae, ДНК Chlamydia trahomatis, ДНК Mycoplasma genitalium, ДНК Trichomonas vaginalis (кол.  ))
))1 — — ВПЧ 6/11 1 — — ВПЧ (анализ крови на папилломавирус
высокого онкогенного риска)1 — — Свертывающая система крови:
фибриноген, протромбин + МНО,
АЧТВ, антитромбин 31 1 1 Тромбиновое время 1 1 1 D-димер 1 1 1 Мазок на онкоцитологию 2 препарата 1 — — Обследование перед ЭКО. Check-up «Программа бесплодие» в ЦКБ РАН – Женское и мужское здоровье
Обследование женщины Прием (осмотр, консультация) врача-акушера-гинеколога, имеющего ученую степень К.М.Н. (уч. звание «доцент») первичный 2300 Определение антител к бледной трепонеме (Treponema Pallidum) в нетрепонемных тестах (RPR, РМП) (качественное исследование) в сыворотке крови (экспресс метод) 300 Взятие крови из периферической вены 350 Определение антител к вирусу иммунодефицита человека ВИЧ-1 и ВИЧ-2 в крови: HIV 1/2 460 Определение антигена к вирусу гепатита B (HbsAg Hepatitis B virus) в крови 345 Определение общих антител к вирусному гепатиту C (Hepatitis C virus) в крови: Аnti-HCV total 675 Молекулярно-биологическое исследование крови на вирус простого герпеса типа 1, 2 (Herpes Simplex virus 1, 2) 530 Получение цервикального мазка 250 Микробиологическое (культуральное) исследование отделяемого женских половых органов на уреаплазму (Ureaplasma urealyticum) 780 Микробиологическое (культуральное) исследование отделяемого женских половых органов на микоплазму (Mycoplasma hominis) 780 Молекулярно-биологическое исследование соскоба цервикального эпителия на цитомегаловирус (Cytomegalovirus) 235 Микробиологическое (культуральное) исследование отделяемого женских половых органов на аэробные и факультативно-анаэробные микроорганизмы 700 Молекулярно-биологическое исследование соскоба цервикального эпителия на вирус простого герпеса 1, 2 (Herpes simplex virus) 235 Взятие крови из периферической вены 350 Комплекс исследований для проведения переливания крови и её компонентов: определение группы крови, резус-принадлежности, фенотипа антигенов: С, с, Сw, Е, е, К, к антиэритроцитарных антител (антител к антигенам эритроцитов) 1250 Общий (клинический) анализ крови развернутый 515 Исследование уровня общего белка в крови 190 Исследование уровня мочевины в крови 190 Исследование уровня креатинина в крови 190 Исследование уровня общего, свободного и связанного билирубина в крови 380 Исследование уровня глюкозы в крови 220 Исследование уровня натрия, калия в крови 600 Исследование уровня аспартат-трансаминазы (АСТ) в крови 190 Исследование уровня аланин-трансаминазы (АЛТ) в крови 190 Исследование уровня щелочной фосфатазы (ЩФ) в крови 190 Исследование уровня фибриногена в крови 270 Исследование агрегации тромбоцитов с АДФ 700 Определение протромбинового (тромбопластинового) времени в крови и международного нормализованного отношения МНО 270 Определение времени свертывания плазмы крови, активированного каолином и (или) кефалином (АЧТВ) 250 Исследование уровня антитромбина III в крови 390 Исследование уровня фибриногена в крови 270 Общий (клинический) анализ мочи 285 Определение антител класса M (IgM) к вирусу краснухи (Rubella virus) в крови: Аnti-Rubella virus IgM 550 Определение антител класса G (IgG) к вирусу краснухи (Rubella virus) в крови: Аnti-Rubella virus IgG 430 Получение цервикального мазка 250 Микроскопическое исследование влагалищных мазков 390 Цитологическое исследование соскобов шейки матки и цервикального канала методом жидкостной цитологии 2100 Получение цервикального мазка 250 Рентгенография легких 1500 Регистрация, расшифровка, описание и интерпретация электрокардиографических данных (ЭКГ) 1000 Прием (осмотр, консультация) врача-терапевта первичный 1300 Ультразвуковое исследование молочных желез и регионарных лимфатических узлов 2800 Прием (осмотр, консультация) врача-акушера-гинеколога повторный 1500 Итого 26700 (PDF) Comparative analysis of bacterial microflora in the female genital tract by real-time PCR and massive parallel sequencing
Спецвыпуск № 10, 2017 «ЛАБОРАТОРИЯ ЛПУ»
38
Лабораторная диагностика
определена при помощи микроскопических методов,
однако высокие требования к подготовке персонала,
низкая пропускная способность и невозможность иден-
тификации видов микроорганизмов при этом подходе
побуждают исследователей к разработке альтернатив-
ных методов анализа состояния микрофлоры.
 В послед-
В послед-ние годы, прежде всего в России, с этой целью все шире
используются методы, основанные на количественной
полимеразной цепной реакции с детекцией в реальном
времени (ПЦР-РВ), которые позволяют оценить соотно-
шение содержания различных микроорганизмов через
соотношения числа копий специфических фрагментов
их ДНК [6-12]. Диагностические наборы, основанные на
ПЦР, позволяют выявлять ДНК различных видов бак-
терий, включая некультивируемые, а также проводить
количественные оценки ее содержания в ДНК ОБМ.
Количественные оценки содержания разных видов
бактерий в одних и тех же клинических пробах, полу-
ченные разными методами, а также при повторном
анализе одним методом одной и той же пробы, могут
заметно различаться, что указывает на погрешность
используемых методов. Понимание вклада погрешно-
стей метода в результат исследования необходимо для
правильной интерпретации получаемых результатов.

Выявление этих погрешностей требует применения
референсных методов, характеризующихся более вы-
сокой точностью, чем испытываемая методика.
В настоящей работе произведен анализ количествен-
ного содержания ДНК лактобактерий и наиболее рас-
пространенных условно-патогенных микроорганизмов
в женских урогенитальных соскобах, осуществленный
с помощью двух подходов: ПЦР-РВ с использованием
наборов реагентов производства АО «Вектор-Бест»
и массового параллельного секвенирования (МПС) на
платформе GS Junior (Roche, Швейцария), использо-
ванного в качестве референсного метода.
Материалы и методы
Для исследования использовали урогенитальные
соскобы от пациенток репродуктивного возраста
(14–50 лет), поступивших в отделения ООО «ИНВИТРО»
(г. Москва и г. Новосибирск) на обследование по пово-
ду подозрения на инфекции, передаваемые половым
путем в течение двух месяцев 2012 года.
 Все данные
Все данныебыли деперсонализированы, клинические данные не
предоставлялась. Забор материала проводили в транс-
портный раствор (АО «Вектор-Бест», г. Новосибирск,
Россия). Исходная выборка составила 1100 образцов.
Выделение нуклеиновых кислот проводили из
100 мкл пробы с помощью набора реагентов «РеалБест
ДНК-экспресс» (АО «Вектор-Бест»). Наличие ингиби-
рования ПЦР контролировали, учитывая результаты
амплификации ДНК внутреннего контрольного образца
(ВКО), входящего в состав набора для выделения.
Выявление специфических нуклеиновых кислот
и количественные оценки. Наборы реагентов «Ре-
алБест ДНК Gardnerella vaginalis/Atopobium vaginae»,
«РеалБест ДНК Prevotella species/Leptotrichia amnionii
group», «РеалБест ДНК Mobiluncus mulieris/Mobiluncus
curtisii» «РеалБест ДНК Saccharimonas aalborgensis (TM7)/
BVAB2», «РеалБест ДНК Mycoplasma genitalium», «Реал-
Бест ДНК Chlamydia trachomatis», «РеалБест ДНК Neisseria
gonorrhoreae» и «РеалБест ДНК Trichomonas vaginalis»
(АО «Вектор-Бест») использовали для выявления ДНК
соответствующих условно-патогенных микроорганизмов
(УПМ).
 18 образцов (см. раздел «Результаты и обсужде-
18 образцов (см. раздел «Результаты и обсужде-ние») было также проанализировано набором «Фемоф-
лор 16» («ДНК-технология», Москва, Россия), предназ-
наченным для определения ДНК ЛБ и широкого спектра
УПМ в общей бактериальной массе. Определение доли
ДНК ЛБ в ДНК ОБМ проводили с использованием набора
реагентов «РеалБест Лактонорм» (АО «Вектор-Бест»).
Оценку доли ДНК G. vaginalis, A. vaginae, Prevotella spp.
и Leptotrichia amnionii group в ДНК ОБМ проводили
с использованием программы «РеалБест Диагностика»
(АО «Вектор-Бест»). Для всех маркеров мишенями для
амплификации служили участки гена 16S рРНК.
Дизайн библиотек ампликонов и последова-
тельности праймеров для метагеномного анализа
с использованием МПС на платформе GS Junior. Ам-
плификацию участков гена 16S рРНК производили с ис-
пользованием слитых праймеров, состоящих из блоков
служебных последовательностей платформы Roche
Junior (последовательность того или иного универсаль-
ного праймера, молекулярного идентификатора – MID,
ключа и т.
 п.) и, расположенной на 3’ – конце последо-
п.) и, расположенной на 3’ – конце последо-вательности, специфичной для мишени. В качестве спе-
цифичных последовательностей использовали прямой
праймер «342F» – CTACGGGAGGCAGCAG и обратные
праймеры «806R» – GGACTACCGGGGTATCT, обес-
печивающий амплификацию участка гена 16S рРНК,
включающего вариабельные участки v3-v5, либо
«1053R» – CTGACGACAGCCATGC, позволяющий ам-
плифицировать вариабельные участки v3-v6. Выбор
последовательностей служебных блоков и общий
дизайн слитых праймеров производили согласно ре-
комендациям производителя в варианте LIB-L.
ПЦР участков гена 16S рРНК для МПС. ПЦР прово-
дили на термоциклере CFX96 Real Time System (Bio-Rad,
США) в режиме детекции флуоресценции в реальном
времени. Реакционная смесь объёмом 50 мкл включа-
ла по 0,2 мкМ каждого праймера, по 0,2 мМ каждого
дНТФ, до 20 мкл образца ДНК, 10 мкл Phusion HF PCR
Buffer (Thermo), 20 u/мл Phusion HotStart Polymerase
(Thermo), бидистиллированную воду до конечного объ-
ёма 50 мкл.
 Температурный профиль реакции: 98 °С –
Температурный профиль реакции: 98 °С –1 мин 30 сек; 5 циклов 98 °С – 10 сек, 56 °С – 30 сек,
72 °С – 15 сек; затем 24 цикла 98 °С – 10 сек, 72 °С – 30 сек;
достройка 72 °С – 2 мин и хранение на 12 °С.
Секвенирование пулов полученных ампликонов
проводили на платформе Roche Junior с использова-
нием наборов Titanium и протоколов на 200 циклов
прокачки дНТФ (для 18 образцов использовались на-
боры Titanium Plus и протокол на 400 прокачки дНТФ)
согласно рекомендациям фирмы-производителя.
Покрытие составило порядка 10000 прочтений на один
образец (от 5600 до ~15000 в разных образцах ДНК).
Анализ данных. Первичный анализ данных про-
изводился с помощью программного обеспечения
Транспорт ДНК в бактериях | Nature Reviews Молекулярная клеточная биология
- 1
Ву, Л. Дж. И Эррингтон, Дж. Bacillus subtilis Белок SpoIIIE, необходимый для сегрегации ДНК во время асимметричного деления клеток.
 Наука 264 , 572–575 (1994).
Наука 264 , 572–575 (1994).CAS Статья Google ученый
- 2
Wu, L.J., Lewis, P.J., Allmansberger, R., Hauser, P.M. & Errington, J.Подобный конъюгации механизм разделения преспоровых хромосом во время споруляции в Bacillus subtilis . Genes Dev. 9 , 1316–1326 (1995). Ссылки 1 и 2 сообщают об открытии функции сегрегации хромосом SpoIIIE.
CAS Статья Google ученый
- 3
Ву, Л. Дж. И Эррингтон, Дж. Локализация в перегородке белка разделения хромосомы SpoIIIE в Bacillus subtilis . EMBO J. 16, 2161–2169 (1997).
- 4
Бат, Дж., Ву, Л. Дж., Эррингтон, Дж. И Ван, Дж. С. Роль Bacillus subtilis SpoIIIE в транспорте ДНК через перегородку деления материнской клетки и преспоры. Наука 290 , 995–997 (2000). Демонстрация отслеживания ДНК с помощью белка SpoIIIE in vitro .

CAS Статья Google ученый
- 5
Foulger, D. & Errington, J.Роль гена споруляции spoIIIE в регуляции экспрессии преспороспецифичных генов у Bacillus subtilis . Мол. Microbiol. 3 , 1247–1255 (1989).
CAS Статья Google ученый
- 6
Шарп М. Э. и Эррингтон Дж. Постсептационное разделение хромосом у бактерий. Proc Natl Acad Sci USA 92 , 8630–8634 (1995). Демонстрация того, что SpoIIIE играет общую роль в сегрегации хромосом.
CAS Статья Google ученый
- 7
Бриттон Р. А. и Гроссман А. Д. Синтетические летальные фенотипы, вызванные мутациями, влияющими на разделение хромосом в Bacillus subtilis . J. Bacteriol. 181 , 5860–5864 (1999).
CAS PubMed PubMed Central Google ученый
- 8
Бегг, К.
 Дж., Дьюар, С.J. & Donachie, W. D. Новый ген деления клеток Escherichia coli , ftsK . J. Bacteriol. 177 , 6211–6222 (1995). Открытие функции клеточного деления белка FtsK.
Дж., Дьюар, С.J. & Donachie, W. D. Новый ген деления клеток Escherichia coli , ftsK . J. Bacteriol. 177 , 6211–6222 (1995). Открытие функции клеточного деления белка FtsK. CAS Статья Google ученый
- 9
Diez, AA, Farewell, A., Nannmark, U. & Nyström, T. Мутация в гене ftsK из Escherichia coli влияет на разделение клеток, выживание в стационарной фазе, адаптацию к стрессу, и экспрессия гена, кодирующего стрессовый белок UspA. J. Bacteriol. 179 , 5878–5883 (1997).
CAS Статья Google ученый
- 10
Wang, L. & Lutkenhaus, J. FtsK является важным белком деления клеток, который локализуется в перегородке и индуцируется как часть SOS-ответа. Мол. Microbiol. 29 , 731–740 (1998).
CAS Статья Google ученый
- 11
Ю.
 , Х.-C., Tran, A.H., Sun, Q. & Margolin, W. Локализация белка клеточного деления FtsK в перегородке Escherichia coli и идентификация потенциального N-концевого целевого домена. J. Bacteriol. 180 , 1296–1304 (1998).
, Х.-C., Tran, A.H., Sun, Q. & Margolin, W. Локализация белка клеточного деления FtsK в перегородке Escherichia coli и идентификация потенциального N-концевого целевого домена. J. Bacteriol. 180 , 1296–1304 (1998).CAS PubMed PubMed Central Google ученый
- 12
Sharp, M. D. & Pogliano, K. Анализ слияния мембран in vivo показывает, что SpoIIIE участвует в заключительных стадиях поглощения во время споруляции Bacillus subtilis . Proc Natl Acad Sci USA 96 , 14553–14558 (1999). Демонстрация функции слияния мембран белка SpoIIIE во время споруляции.
CAS Статья Google ученый
- 13
Эррингтон, Дж. Споруляция Bacillus subtilis : регуляция экспрессии генов и контроль морфогенеза. Microbiol. Ред. 57 , 1–33 (1993).
CAS PubMed PubMed Central Google ученый
- 14
Польяно, К.
 и другие. Жизненно важный краситель для изучения динамики мембран у бактерий: новый механизм, контролирующий септацию во время споруляции Bacillus subtilis . Мол. Microbiol. 31 , 1149–1159 (1999).
и другие. Жизненно важный краситель для изучения динамики мембран у бактерий: новый механизм, контролирующий септацию во время споруляции Bacillus subtilis . Мол. Microbiol. 31 , 1149–1159 (1999).CAS Статья Google ученый
- 15
Yu, X.-C., Weihe, E. K. & Margolin, W. Роль С-конца FtsK в сегрегации хромосом Escherichia coli . J. Bacteriol. 180 , 6424–6428 (1998).
CAS PubMed PubMed Central Google ученый
- 16
Лю, Г., Дрейпер, Г. С. и Доначи, В. Д. FtsK — это бифункциональный белок, участвующий в делении клеток и локализации хромосом в Escherichia coli . Мол. Microbiol. 29 , 893–903 (1998).
CAS Статья Google ученый
- 17
Штайнер, В., Лю, Г., Donachie, W. D. & Kuempel, P. Цитоплазматический домен белка FtsK необходим для разделения димеров хромосом.
 Мол. Microbiol. 31 , 579–583 (1999). Неожиданное открытие роли FtsK в разрешении димеров хромосом.
Мол. Microbiol. 31 , 579–583 (1999). Неожиданное открытие роли FtsK в разрешении димеров хромосом. CAS Статья Google ученый
- 18
Recchia, G. D., Aroyo, M., Wolf, D., Blakely, G. & Sherratt, D. J. FtsK-зависимые и независимые пути сайт-специфической рекомбинации Xer. EMBO J. 18 , 5724–5734 (1999).
CAS Статья Google ученый
- 19
Барре, Ф.-Х. и другие. FtsK действует в процессинге промежуточного звена Холлидея во время бактериальной сегрегации хромосом. Genes Dev. 14 , 2976–2988 (2000).
CAS Статья Google ученый
- 20
Блейкли, Г., Колломс, С., May, G., Burke, M. & Sherratt, D. J. Escherichia coli XerC-рекомбиназа необходима для хромосомной сегрегации при делении клеток. Нью Биол 3 , 789–798 (1991).

CAS PubMed Google ученый
- 21
Kuempel, PL, Henson, JM, Dircks, L., Tecklenburg, M. & Lim, DF dif , recA -независимый сайт рекомбинации в концевой области хромосомы Escherichia coli . Нью Биол 3 , 799–811 (1991).
CAS PubMed Google ученый
- 22
Sciochetti, S. A., Piggot, P. J., Sherratt, D. J. & Blakely, G. Локус ripX Bacillus subtilis кодирует сайт-специфическую рекомбиназу, участвующую в правильном разделении хромосом. J. Bacteriol. 181 , 6053–6062 (1999).
CAS PubMed PubMed Central Google ученый
- 23
Лимон, К.П., Курстер И. и Гроссман А. Д. Влияние мутантов терминации репликации на разделение хромосом в Bacillus subtilis . Proc Natl Acad Sci USA 98 , 212–217 (2001).
CAS PubMed Google ученый
- 24
Скиочетти, С.
 А. и Пиггот, П. Дж. Рассказ о двух геномах: разрешение димерных хромосом в Escherichia coli и Bacillus subtilis . Res.Microbiol. 151 , 503–511 (2000).
А. и Пиггот, П. Дж. Рассказ о двух геномах: разрешение димерных хромосом в Escherichia coli и Bacillus subtilis . Res.Microbiol. 151 , 503–511 (2000).CAS Статья Google ученый
- 25
Скиочетти, С. А., Пиггот, П. Дж. И Блейкли, Г. В. Идентификация и характеристика сайта dif из Bacillus subtilis . J. Bacteriol. 183 , 1058–1068 (2001).
CAS Статья Google ученый
- 26
Томура, Т.и другие. Ген, ингибирующий споруляцию, в плазмиде pSA1.1, образующей ямки, из Streptomyces azureus . Biosci. Biotechnol. Biochem. 57 , 438–443 (1993).
CAS Статья Google ученый
- 27
Pettis, G. S. & Gohen, S. N. Перенос плазмиды и экспрессия продукта гена переноса ( tra ) плазмиды pIJ101 регулируются во времени в течение жизненного цикла Streptomyces lividans .
 Мол. Microbiol. 19 , 1127–1135 (1996).
Мол. Microbiol. 19 , 1127–1135 (1996).CAS Статья Google ученый
- 28
Kosono, S., Kataoka, M., Seki, T. и Yoshida, T. Белок TraB, который опосредует межмицелиальный перенос плазмиды pSN22 Streptomyces , имеет функциональные NTP-связывающие мотивы и локализован к цитоплазматической мембране. Мол. Microbiol. 19 , 397–405 (1996).
CAS Статья Google ученый
- 29
Ферт, Н., Ippen-Ihler, K. & Skurray, R.A. в Escherichia coli и Salmonella: Cellular and Molecular Biology (ред. Neidhardt, F. C. et al.) 2377–2401 (Американское общество микробиологии, Вашингтон, округ Колумбия, 1996).
Google ученый
- 30
Ланка, Э. и Уилкинс, Б. М. Реакции обработки ДНК при бактериальной конъюгации. Annu. Rev. Biochem. 64 , 141–169 (1995).
CAS Статья Google ученый
- 31
Кендалл, К.Дж. И Коэн, С. Н. Полная нуклеотидная последовательность плазмиды Streptomyces lividans pIJ101 и корреляция последовательности с генетическими свойствами. J. Bacteriol. 170 , 4634–4651 (1988).
CAS Статья Google ученый
- 32
Hagège, J. et al. Передаточные функции конъюгативного интегрирующего элемента pSAM2 из Streptomyces ambofaciens : характеристика системы кил – кор , связанной с переносом. J. Bacteriol. 175 , 5529–5538 (1993).
Артикул Google ученый
- 33
Катаока, М., Секи, Т. и Йошида, Т. Пять генов, участвующих в самопередаче pSN22, плазмиды Streptomyces . J. Bacteriol. 173 , 7975–7981 (1991).
CAS Статья Google ученый
- 34
Адамс, Р. Т. и Уэйк, Р.G. Высокоспецифичное мечение конца хромосомы Bacillus subtilis . J. Bacteriol. 143 , 1036–1038 (1980).
CAS PubMed PubMed Central Google ученый
- 35
Данн, Г., Джеффс, П., Манн, Н. Х., Торгерсен, Д. М. и Янг, М. Взаимосвязь между репликацией ДНК и индукцией споруляции в Bacillus subtilis . J. Gen. Microbiol. 108 , 189–195 (1978).
CAS Статья Google ученый
- 36
Sargent, M. G. Специфическая маркировка конца хромосомы Bacillus subtilis . J. Bacteriol. 143 , 1033–1035 (1980).
CAS PubMed PubMed Central Google ученый
- 37
Льюис, П. Дж., Партридж, С. Р. и Эррингтон, Дж. Σ-факторы, асимметрия и определение судьбы клеток в Bacillus subtilis . Proc Natl Acad Sci USA 91 , 3849–3853 (1994).
CAS Статья Google ученый
- 38
Heinemann, J. A. & Sprague, G. G. J. Бактериальные конъюгативные плазмиды мобилизуют перенос ДНК между бактериями и дрожжами. Nature 340 , 205–209 (1989).
CAS Статья Google ученый
- 39
Hooykaas, P.J.& Schilperoort, R.A. Agrobacterium и генная инженерия растений. Завод Мол. Биол. 19 , 15–38 (1992).
CAS Статья Google ученый
- 40
Куник Т. и др. Генетическая трансформация клеток HeLa Agrobacterium . Proc Natl Acad Sci USA 98 , 1871–1876 (2001).
CAS Статья Google ученый
- 41
Gomis-Rüth, F.X. et al. Бактериальный белок конъюгации TrwB напоминает кольцевые геликазы и F1-АТФазу. Nature 409 , 637–641 (2001). Кристаллическая структура белка конъюгации TrwB обеспечивает вероятный механизм конъюгативного транспорта ДНК и, возможно, SpoIIIE-опосредованного транспорта ДНК посредством процесса типа кольцевой геликазы.
Артикул Google ученый
- 42
Хингорани М. М. и О’Доннелл М. Рассказ о тороидах в метаболизме ДНК. Nature Rev. Mol. Cell Biol. 1 , 22–30 (2000).
CAS Статья Google ученый
- 43
Патель, С. С. и Пича, К. М. Структура и функция гексамерных геликаз. Annu. Rev. Biochem. 69 , 651–697 (2000).
CAS Статья Google ученый
- 44
Партридж, С. Р. и Эррингтон, Дж. Важность морфологических событий и межклеточных взаимодействий в регуляции экспрессии преспор-специфичных генов во время споруляции у Bacillus subtilis . Мол. Microbiol. 8 , 945–955 (1993).
CAS Статья Google ученый
- 45
Зальцберг, С. Л., Зальцберг, А. Дж., Керлавадж, А. Р., Томб, Ж.-Ф. Искаженные олигомеры и источники репликации. Gene 217 , 57–67 (1998).
CAS Статья Google ученый
- 46
Pogliano, K., Hofmeister, A. E. & Losick, R.Исчезновение фактора транскрипции σ E из предспоры и фосфатазы SpoIIE из материнской клетки способствует установлению клеточно-специфической экспрессии гена во время споруляции у Bacillus subtilis . J. Bacteriol. 179 , 3331–3341 (1997).
CAS Статья Google ученый
- 47
Morris, P. D. и Raney, K. D. ДНК-геликазы вытесняют стрептавидин из олигонуклеотидов, меченных биотином. Биохимия 38 , 5164–5171 (1999).
CAS Статья Google ученый
- 48
Дубнау Д. Поглощение ДНК бактериями. Annu. Rev. Microbiol. 53 , 217–244 (1999).
CAS Статья Google ученый
- 49
Letellier, L., Plançon, L., Bonhivers, M. & Boulanger, P. Транспорт ДНК фага через мембраны. Res. Microbiol. 150 , 499–505 (1999).
CAS Статья Google ученый
- 50
Хендрикс, Р. В. Упаковка ДНК бактериофага: шестерни РНК в машине для транспортировки ДНК. Cell 94 , 147–150 (1998).
CAS Статья Google ученый
- 51
Zerfas, P. M., Kessel, M., Quintero, E. J. и Weiner, R. M. Тонкие структурные доказательства разделения нуклеоида и цитоплазмы клеточной мембраны во время образования почек у видов Hyphomonas . J. Bacteriol. 179 , 148–156 (1997).
CAS Статья Google ученый
- 52
Gelles, J. & Landick, R. РНК-полимераза как молекулярный двигатель. Cell 93 , 13–16 (1998).
CAS Статья Google ученый
- 53
Yin, H. et al. Транскрипция против приложенной силы. Наука 270 , 1653–1657 (1995).
CAS Статья Google ученый
- 54
Harada, Y. et al. Прямое наблюдение вращения ДНК во время транскрипции с помощью РНК-полимеразы Escherichia coli . Nature 409 , 113–115 (2001).
CAS Статья Google ученый
- 55
Weiss, S. Измерение конформационной динамики биомолекул с помощью флуоресцентной спектроскопии одиночных молекул. Nature Struct. Биол. 7 , 724–729 (2000).
CAS Статья Google ученый
- Beadle, G.W .; Татум, Э. Л. (1941) . «Генетический контроль биохимических реакций в нейроспоре». Труды Национальной академии наук . 27 (11): 499–506. DOI: 10.1073 / pnas.27.11.499. PMC 1078370. PMID 16588492
- Lederberg J, Tatum EL (1946). «Рекомбинация генов в E. coli ». Природа . 158 (4016): 558.DOI: 10.1038 / 158558a0
- Определить геном.
- Опишите состав бактериальной хромосомы.
- Назовите ферменты, которые позволяют бактериальной ДНК становиться кольцевой, суперспиральной и раскручивающейся во время репликации ДНК.
- Кратко опишите процесс репликации ДНК.
- Укажите функцию следующих ферментов в репликации бактериальной ДНК:
- ДНК-полимераза III
- ДНК-полимераза II
- ДНК-геликаза
- primase
- ДНК-лигаза
- Укажите функцию ДНК.
- С точки зрения синтеза белка, кратко опишите процесс транскрипции и трансляции.
- Кратко опишите, как следующие антибактериальные химиотерапевтические агенты влияют на бактерии:
- фторхинолоны (норфлоксацин, ломефлоксацин, флероксацин, ципрофлоксацин, эноксацин, тровафлоксацин и др.)
- триметоприм и сульфаметоксазол
- Транскрипция: Рибонуклеиновая кислота (РНК) синтезируется комплементарным спариванием оснований рибонуклеотидов с дезоксирибонуклеотидами для соответствия части одной цепи ДНК, называемой геном.Хотя гены присутствуют в обеих цепях ДНК, для любого данного гена транскрибируется только одна цепь. После транскрипции генов в мРНК, 30S- и 50S-рибосомные субъединицы присоединяются к мРНК, и тРНК вставляет правильные аминокислоты, которые впоследствии соединяются с образованием полипептида или белка посредством процесса, называемого трансляцией.
- Трансляция : Во время трансляции определенные молекулы тРНК захватывают определенные аминокислоты, переносят эти аминокислоты в рибосомы и вставляют их на свои места в соответствии с сообщением «мРНК».«Это достигается за счет спаривания комплементарных оснований антикодоновой части молекул тРНК с кодонами вдоль мРНК.
- Фторхинолоны (норфлоксацин, ломефлоксацин, флероксацин, ципрофлоксацин, эноксацин, тровафлоксацин и т. Д.) Действуют путем ингибирования одной или нескольких топоизомераз, ферментов, необходимых для синтеза бактериальных нуклеиновых кислот.
- Ко-тримоксазол, комбинация сульфаметоксазола и триметоприма, блокирует ферменты на пути бактерий, необходимых для синтеза тетрагидрофолиевой кислоты, кофактора, необходимого бактериям для производства нуклеотидных оснований тимина, гуанина, урацила и аденина.Без тетрагидрофолиевой кислоты бактерии не могут синтезировать ДНК или РНК.
- Геном — это сумма генетического материала организма.
- Бактерии содержат одну хромосому двухцепочечной дезоксирибонуклеиновой кислоты (ДНК).
- Область бактериальной цитоплазмы, где расположена хромосома и которая видна при просмотре в электронный микроскоп, называется нуклеоидом.
- Бактериальная хромосома обычно представляет собой физический и генетический круг, становится сверхспиральной и не окружена ядерной мембраной.
- Бактерии не осуществляют митоз или мейоз. Ферменты ДНК-топоизомеразы
- используются для суперспирализации и расслабления бактериальной хромосомы во время репликации и транскрипции ДНК.
- Подобно эукариотической ДНК, прокариотическая ДНК реплицируется путем последовательного раскручивания двух родительских цепей ДНК и последующего комплементарного спаривания нуклеотидов ДНК с каждой родительской цепью.
- Во время репликации ДНК азотистое основание аденин образует водородные связи с тимином, а гуанин образует водородные связи с цитозином.
- Гены, расположенные вдоль ДНК, транскрибируются в молекулы РНК, в первую очередь информационную РНК (мРНК), транспортную РНК (тРНК) и рибосомную РНК (рРНК).Затем матричная РНК транслируется в белок на рибосомах.
- Во время транскрипции рибонуклеиновая кислота (РНК) синтезируется комплементарным спариванием оснований рибонуклеотидов с дезоксирибонуклеотидами, чтобы соответствовать части одной цепи ДНК, называемой геном.
- Во время трансляции определенные молекулы тРНК захватывают определенные аминокислоты, переносят эти аминокислоты на рибосомы и вставляют их в свое надлежащее место в соответствии с «сообщением» мРНК.
- Бактериальные и вирусные геномы действуют как PAMP, стимулируя врожденный иммунитет.
- Некоторые антибактериальные химиотерапевтические средства, подавляющие нормальную репликацию нуклеиновых кислот в бактериях.
- Сумма генетического материала организма называется его ____________. (ANS)
- Бактериальные ферменты, участвующие в раскручивании, репликации и перемотке кольцевой сверхспиральной бактериальной ДНК, называемой ______________. (ANS)
- Опишите общий хромосомный состав большинства бактерий. (ANS)
- Кратко опишите процесс репликации ДНК. (ANS)
- Укажите, какой фермент выполняет следующие функции во время репликации ДНК.
- Раскручивает спиральную ДНК, разрывая водородные связи между комплементарными основаниями. (ANS)
- Синтезирует короткий праймер РНК в начале каждого ориджина репликации. (ANS)
- Добавляет нуклеотиды ДНК к праймеру РНК. (ANS)
- Расщепляет праймер РНК и заменяет нуклеотиды РНК праймера соответствующими нуклеотидами ДНК. (ANS)
- Связывает вместе фрагменты ДНК отстающей цепи. (ANS)
- Укажите общую функцию ДНК. (ANS)
- Определить транскрипцию. (ANS)
- Определить перевод. (ANS)
- Ципрофлоксацин ( Cipro ) используется для лечения различных бактериальных инфекций. Как остановить рост бактерий? (ANS)
- Множественный выбор (ANS)
- 1.
Dorman CJ, Dorman MJ. Суперспирализация ДНК является фундаментальным регуляторным принципом в контроле экспрессии бактериальных генов.Biophys Rev.2016; 8 (3): 209–20.
CAS PubMed PubMed Central Статья Google ученый
- 2.
Дрлика К. Контроль суперспирализации бактериальной ДНК. Mol Microbiol. 1992. 6 (4): 425–33.
CAS PubMed Статья Google ученый
- 3.
Hatfield GW, Benham CJ. Опосредованный топологией ДНК контроль глобальной экспрессии генов в Escherichia coli .Анну Рев Жене. 2002; 36: 175–203.
CAS PubMed Статья Google ученый
- 4.
Трэверс А.А., Мусхелишвили Г. Суперспирализация ДНК — глобальный регулятор транскрипции роста энтеробактерий? Nat Rev Microbiol. 2005. 3 (2): 157–69.
CAS PubMed Статья Google ученый
- 5.
Bauer WR, Crick FHC, Белый JH. Суперспиральная ДНК. Sci Am 1980; 243 (1): 100–113.
- 6.
Boles TC, белый JH, Cozzarelli NR. Структура плектонемно суперспиральной ДНК. J Mol Biol. 1990; 213 (4): 931–51.
CAS PubMed Статья Google ученый
- 7.
Виноград Дж., Лебовиц Дж., Радлофф Р., Уотсон Р., Лайпис П. Скрученная кольцевая форма ДНК вируса полиомы. Proc Natl Acad Sci U S. A. 1965; 53 (5): 1104–11.
CAS PubMed PubMed Central Статья Google ученый
- 8.
Sinden RR. Структура и функции ДНК. 1994 Academic Press.
- 9.
Dillon SC, Dorman CJ. Бактериальные нуклеоид-ассоциированные белки, структура нуклеоидов и экспрессия генов. Nat Rev Microbiol. 2010. 8 (3): 185–95.
CAS PubMed Статья Google ученый
- 10.
Bliska JB, Cozzarelli NR. Использование сайт-специфической рекомбинации в качестве зонда структуры ДНК и метаболизма in vivo .J Mol Biol. 1987. 194 (2): 205–18.
CAS PubMed Статья Google ученый
- 11.
Ян Й, Динг Й, Ленг Ф., Данлэп Д., Финци Л. Белковые петли в суперспиральной ДНК создают большие топологические домены. Nucleic Acids Res. 2018; 46 (9): 4417–24.
CAS PubMed PubMed Central Статья Google ученый
- 12.
Drlica K, Franco RJ, Steck TR.Мутации рифампина и rpoB могут изменять суперспирализацию ДНК в Escherichia coli . J Bacteriol. 1988. 170 (10): 4983–5.
CAS PubMed PubMed Central Статья Google ученый
- 13.
Ма Дж., Ван М. Взаимодействие между суперспирализацией ДНК и элонгацией транскрипции. Транскрипция. 2014a; 5 (3): e28636.
PubMed PubMed Central Статья Google ученый
- 14.
Ма Дж., Бай Л., Ван, Мэриленд. Транскрипция под кручение. Наука. 2013. 340 (6140): 1580–3.
CAS PubMed PubMed Central Статья Google ученый
- 15.
Nudler E. РНК-полимераза в обратном направлении в регуляции генов и стабильности генома. Клетка. 2012. 149 (7): 1438–45.
CAS PubMed Статья Google ученый
- 16.
Le TB, Laub MT. Скорость транскрипции и длина транскрипта определяют формирование границ домена взаимодействия хромосом.EMBO J. 2016; 35 (14): 1582–95.
CAS PubMed PubMed Central Статья Google ученый
- 17.
Анкона М., Бентивольо А., Брэкли К.А., Гоннелла Г., Марендуццо Д. Взрывы транскрипции в неравновесной модели регуляции генов с помощью суперспирализации. Biophys J. 2019; 116: 1–8.
Артикул CAS Google ученый
- 18.
Чонг С., Чен С, Ге Х, Се XS.Механизм транскрипционного взрыва у бактерий. Клетка. 2015; 158 (2): 314–26.
Артикул CAS Google ученый
- 19.
Лю Л.Ф., Ван Дж. Суперспирализация матрицы ДНК во время транскрипции. Proc Natl Acad Sci U S. A. 1987. 84 (20): 7024–7.
CAS PubMed PubMed Central Статья Google ученый
- 20.
Эль Ханафи Д., Босси Л. Активация и подавление промотора leu-500 путем индуцированной транскрипцией суперспирализации ДНК в хромосоме Salmonella .Mol Microbiol. 2000. 37 (3): 583–94.
PubMed Статья Google ученый
- 21.
Ma J, Wang MD. РНК-полимераза — мощный торсионный двигатель. Клеточный цикл. 2014b; 13 (3): 337–8.
CAS PubMed Статья Google ученый
- 22.
Naughton C, Corless S, Gilbert N. Дивергентная транскрипция РНК: роль в раскручивании промотора? Транскрипция. 2013. 4 (4): 162–6.
PubMed PubMed Central Статья Google ученый
- 23.
Rahmouni AR, Wells RD. Прямые доказательства влияния транскрипции на локальную суперспирализацию ДНК in vivo . J Mol Biol. 1992. 223 (1): 131–44.
CAS PubMed Статья Google ученый
- 24.
Цао Ю.П., Ву Х.Й., Лю Л.Ф. Управляемая транскрипцией суперспирализация ДНК: прямые биохимические доказательства из исследований in vitro .Клетка. 1989. 56 (1): 111–8.
CAS PubMed Статья Google ученый
- 25.
Wu HY, Shyy S, Wang JC, Liu LF. Транскрипция генерирует в матрице положительно и отрицательно свернутые домены. Клетка. 1988. 53 (3): 433–40.
CAS PubMed Статья Google ученый
- 26.
Жи X, Ленг Ф. Зависимость суперспирализации транскрипционной ДНК от силы промотора в штаммах с дефицитом топоизомеразы I. Escherichia coli .Ген. 2013; 514 (2): 82–90.
CAS PubMed Статья Google ученый
- 27.
Коричневый PO, Cozzarelli NR. Механизм инверсии знака для ферментативной суперспирализации ДНК. Наука. 1979. 206 (4422): 1081–3.
CAS PubMed Статья Google ученый
- 28.
Геллерт М., Мидзуучи К., О’Ди М.Х., Нэш Х.А. ДНК-гираза: фермент, который превращает сверхспирали в ДНК.Proc Natl Acad Sci U S. A. 1976; 73 (11): 3872–6.
CAS PubMed PubMed Central Статья Google ученый
- 29.
Хиггинс Н.П., Пиблз К.Л., Сугино А., Коццарелли Н.Р. Очистка субъединиц ДНК-гиразы Escherichia coli и восстановление ферментативной активности. Proc Natl Acad Sci U S. A. 1978; 75 (4): 1773–7.
CAS PubMed PubMed Central Статья Google ученый
- 30.
Nöllmann M, Stone MD, Bryant Z, Gore J, Crisona NJ, Hong S-C, Mitelheiser S, Maxwell A, Bustamante C, Cozzarelli NR. Множественные режимы активности ДНК-гиразы Escherichia coli , выявленные с помощью силы и крутящего момента. Nat Struct Mol Biol. 2007. 14 (4): 264–71.
PubMed Статья CAS Google ученый
- 31.
Геллерт М., Мидзуучи К., О’Ди М.Х., Ито Т., Томидзава Д.И. Устойчивость к налидиксовой кислоте: второй генетический признак, участвующий в активности ДНК-гиразы.Proc Natl Acad Sci U S. A. 1977; 74 (11): 4772–6.
CAS PubMed PubMed Central Статья Google ученый
- 32.
Уильямс Н.Л., Максвелл А. Исследование механизма двух ворот ДНК-гиразы с использованием перекрестного связывания цистеина. Биохимия. 1999. 38 (41): 13502–11.
CAS PubMed Статья Google ученый
- 33.
Zechiedrich EL, Khodursky AB, Bachellier S, Schneider R, Chen D, Lilley DM, Cozzarelli NR.Роль топоизомераз в поддержании стационарной суперспирализации ДНК в Escherichia coli . J Biol Chem. 2000. 275 (11): 8103–13.
CAS PubMed Статья Google ученый
- 34.
Stracy M, Lesterlin C, Garza de Leon F, Uphoff S, Zawadzki P, Kapanidis AN. Микроскопия сверхразрешения живых клеток показывает организацию РНК-полимеразы в бактериальном нуклеоиде. Proc Natl Acad Sci U S A 2015; 112 (32): E4390 – E4399.
CAS Статья Google ученый
- 35.
Ровинский Н., Агблеке А.А., Чеснокова О., Панг З., Хиггинс Н.П. Скорости суперспирализации гиразы и элонгации транскрипции контролируют плотность суперспирали в бактериальной хромосоме. PLoS Genet. 2012; 8 (8): e1002845.
CAS PubMed PubMed Central Статья Google ученый
- 36.
Stracy M, Wollman AJM, Kaja E., Gapinski J, Lee J-E, Leek VA, McVie SJ, Mitchenall LA, Maxwell A, Sherratt DJ, et al.Одномолекулярное изображение активности ДНК-гиразы в живых Escherichia coli . Nucleic Acids Res. 2019; 47 (1): 210–20.
PubMed Статья Google ученый
- 37.
Лопес В., Мартинес-Роблес М.Л., Эрнандес П., Кример Д.Б., Шварцман Дж. Б.. Topo IV — это топоизомераза, которая связывает и развязывает сестринские дуплексы во время репликации ДНК. Nucleic Acids Res. 2012. 40 (8): 3563–73.
CAS PubMed Статья Google ученый
- 38.
Zechiedrich EL, Cozzarelli NR. Роль топоизомеразы IV и ДНК-гиразы в разрыве ДНК при репликации в Escherichia coli . Genes Dev. 1995. 9 (22): 2859–69.
CAS PubMed Статья PubMed Central Google ученый
- 39.
Lang KS, Hall AN, Merrikh CN, Ragheb M, Tabakh H, Pollock AJ, Woodward JJ, Dreifus JE, Merrikh H. Конфликты репликации-транскрипции порождают R-петли, которые регулируют выживание и патогенез бактериального стресса.Клетка. 2017; 170 (4): 787–99.
CAS PubMed PubMed Central Статья Google ученый
- 40.
Кузьминов А. Когда топология ДНК становится смертельной — РНК-полимеразы зарываются в свои R-петли, чтобы отстоять свои позиции: новые положительные и отрицательные (супер) повороты в конфликте репликации и транскрипции. Тенденции Genet 2018; 34 (2): 111–120.
CAS PubMed Статья Google ученый
- 41.
Датта Д., Шаталин К., Эпштейн В., Готтесман М. Е., Нудлер Э. Обратное отслеживание связывания РНК-полимеразы с нестабильностью генома в E. coli . Cell 2011; 146 (4): 533–543.
CAS PubMed PubMed Central Статья Google ученый
- 42.
Ланг К.С., Меррих Х. Столкновение титанов макромолекул: конфликты репликации-транскрипции у бактерий. Annu Rev Microbiol. 2018; 8 (72): 71–88.
Артикул CAS Google ученый
- 43.
Дроле М, Би Х, Лю LF. Гиперотрицательная суперспирализация матрицы ДНК во время элонгации транскрипции in vitro. J Biol Chem. 1994. 269 (3): 2068–74.
CAS PubMed Google ученый
- 44.
Ленг Ф., Амадо Л., МакМакен Р. Связывание суперспирализации ДНК с транскрипцией в определенных белковых системах. J Biol Chem. 2004. 279 (46): 47564–71.
CAS PubMed Статья Google ученый
- 45.
Usongo V, Nolent F, Sanscartier P, Tanguay C, Broccoli S, Baaklini I, Drlica K, Drolet M. Истощение активности РНКазы HI в Escherichia coli без топоизомеразы I ДНК приводит к дефектам суперспирализации и сегрегации ДНК. Mol Microbiol. 2008. 69 (4): 968–81.
CAS PubMed PubMed Central Google ученый
- 46.
Cheung KJ, Badarinarayana V, Selinger DW, Janse D, Church GM. Скрининг антибиотиков на основе микрочипов определяет регулирующую роль суперспирализации в ответе на осмотический стресс Escherichia coli .Genome Res. 2003. 13 (2): 206–15.
CAS PubMed PubMed Central Статья Google ученый
- 47.
Питер Б.Дж., Арсуага Дж., Брейер А.М., Ходурский А.Б., Браун П.О., Коццарелли Н.Р. Геномный транскрипционный ответ на потерю хромосомной суперспирализации в Escherichia coli . Genome Biol. 2004; 5 (11): R87.
PubMed PubMed Central Статья Google ученый
- 48.
Лим Х.М., Льюис Д.Е., Ли Х.Дж., Лю М., Адхья С. Влияние изменения суперспирализации ДНК на транскрипцию и ее регуляцию. Биохимия. 2003. 42 (36): 10718–25.
CAS PubMed Статья Google ученый
- 49.
Дорман С.Дж., Дорман М.Дж. Контроль транскрипции гена вирулентности путем непрямого считывания в Vibrio cholerae и Salmonella enterica serovar typhimurium. Environ Microbiol. 2017; 19 (10): 3834–45.
CAS PubMed PubMed Central Статья Google ученый
- 50.
Cameron AD, Dorman CJ. Фундаментальный регуляторный механизм, действующий через OmpR и топологию ДНК, контролирует экспрессию островов патогенности Salmonella SPI-1 и SPI-2. PLoS Genet. 2012; 8 (3): e1002615.
CAS PubMed PubMed Central Статья Google ученый
- 51.
Роуз Р., Вест С.М., Сосинский А., Лю П., Манн Р.С., Хониг Б. Роль формы ДНК в распознавании ДНК-белок. Природа. 2009. 461 (7268): 1248–53.
CAS PubMed PubMed Central Статья Google ученый
- 52.
Коржева Н., Мустаев А., Нудлер Э., Никифоров В., Гольдфарб А. Механистическая модель комплекса элонгации РНК-полимеразы Escherichia coli в: Симпозиумы CSH по количественной биологии , вып.LXIII Cold Spring Harbor Press, стр.1998; 337-345.
- 53.
Нудлер Э., Мустаев А., Лухтанов Э., Гольдфарб А. Гибрид РНК-ДНК поддерживает регистр транскрипции, предотвращая возврат РНК-полимеразы. Клетка. 1997; 89: 33–41.
CAS PubMed Статья Google ученый
- 54.
Мустаев А., Робертс Дж., Готтесман М. Удлинение транскрипции. Транскрипция. 2017; 8: 150–61.
CAS PubMed PubMed Central Статья Google ученый
- 55.
Washburn RS, Gottesman ME. Регуляция удлинения и окончания транскрипции. Биомолекулы. 2015; 5: 1063–78.
CAS PubMed PubMed Central Статья Google ученый
- 56.
Strauß M, Vitiello C, Schweimer K, Gottesman M, Rösch P, Knauer SH. Транскрипция регулируется взаимодействием NusA: NusG. Nucleic Acids Res. 2016; 44: 5971–82.
PubMed PubMed Central Статья CAS Google ученый
- 57.
Эпштейн В., Камартапу В., МакГэри К., Светлов В., Уберхайде Б., Прошкин С., Миронов А., Нудлер Е. (2014) UvrD способствует репарации ДНК, вытягивая РНК-полимеразу назад. Природа. 2014; 505: 372–7.
CAS PubMed PubMed Central Статья Google ученый
- 58.
Борухов С., Сагитов В., Гольдфарб А. (1993) факторы расщепления транскрипта из E . кишечная палочка . Клетка. 1993. 72: 459–66.
CAS PubMed Статья Google ученый
- 59.
Борухов С., Ли Дж., Лаптенко О. Факторы элонгации транскрипции бактерий: новое понимание молекулярного механизма действия. Mol Microbiol. 2005; 55 (5): 1315–24.
CAS PubMed Статья Google ученый
- 60.
Эльгамал С., Арцимович И., Ибба М. Поддержание сцепления транскрипции и трансляции с помощью фактора элонгации P mBio 2016; 7: e01373 – e01316.
- 61.
Dages S, Dages K, Zhi X, Ленг Ф. Ингибирование промотора gyrA за счет суперспирализации связанной с транскрипцией ДНК в Escherichia coli .Научный доклад 2018; 8 (1): 14759.
PubMed PubMed Central Статья CAS Google ученый
- 62.
Menzel R, Gellert M. Регулирование генов E. coli ДНК-гиразы: гомеостатический контроль суперспирализации ДНК. Клетка. 1983; 34 (1): 105–13.
CAS PubMed Статья Google ученый
- 63.
Menzel R, Gellert M. Модуляция транскрипции с помощью суперспирализации ДНК: делеционный анализ промоторов Escherichia coli gyrA и gyrB .Proc Natl Acad Sci U S. A. 1987. 84 (12): 4185–9.
CAS PubMed PubMed Central Статья Google ученый
- 64.
Straney R, Krah R, Menzel R. Мутации в последовательности -10 TATAAT промотора gyrA влияют как на силу промотора, так и на чувствительность к суперспирализации ДНК. J Bacteriol. 1994. 176 (19): 5999–6006.
CAS PubMed PubMed Central Статья Google ученый
- 65.
Уннираман С., Нагараджа В. Регулирование оперона ДНК-гиразы в Mycobacterium smegmatis : особый механизм транскрипции, стимулированной релаксацией. Гены Клетки. 1999. 4 (12): 697–706.
CAS PubMed Статья Google ученый
- 66.
Schneider R, Travers A, Muskhelishvili G. Экспрессия гена Escherichia coli fis сильно зависит от сверхспиральной плотности ДНК. Mol Microbiol.2000. 38 (1): 167–75.
CAS PubMed Статья Google ученый
- 67.
Ахмед В., Менон С., Картик П.В., Нагараджа В. Ауторегуляция экспрессии топоизомеразы I с помощью сверхспиральной чувствительной транскрипции. Nucleic Acids Res. 2016; 44 (4): 1541–52.
PubMed Статья Google ученый
- 68.
Tse-Dinh Y, Beran R. Множественные промоторы для транскрипции E.coli ДНК-топоизомеразы I и их регуляция с помощью суперспирализации ДНК. J Mol Biol. 1988. 202 (4): 735–42.
CAS PubMed Статья Google ученый
- 69.
Blot N, Mavathur R, Geertz M, Travers A, Muskhelishvili G. Гомеостатическая регуляция чувствительности к суперспирализации координирует транскрипцию бактериального генома. EMBO Rep. 2006; 7 (7): 710–5.
CAS PubMed PubMed Central Статья Google ученый
- 70.
DiNardo S, Voelkel KA, Sternglanz R, Reynolds AE, Wright A. Мутанты ДНК-топоизомеразы I Escherichia coli имеют компенсаторные мутации в генах ДНК-гиразы. Клетка. 1982. 31 (1): 43–51.
CAS PubMed Статья Google ученый
- 71.
Феррандис М.Дж., Мартин-Галиано А.Дж., Арнанс К., Камачо-Согуэро I, Тирадо-Велес Ю.М., де ла Кампа АГ. Увеличение отрицательной суперспирализации у бактерий выявляет кластеры генов, реагирующих на топологию, и гомеостатический ответ, опосредованный геном топоизомеразы I ДНК.Nucleic Acids Res. 2016; 44 (15): 7292–303.
PubMed PubMed Central Google ученый
- 72.
Franco RJ, Drlica K. Ингибиторы гиразы могут увеличивать экспрессию gyrA и суперспирализацию ДНК. J Bacteriol. 1989. 171 (12): 6573–9.
CAS PubMed PubMed Central Статья Google ученый
- 73.
Pruss GJ, Manes SH, Drlica K. Escherichia coli Мутанты ДНК-топоизомеразы I: повышенная суперспирализация корректируется мутациями рядом с генами гиразы.Клетка. 1982; 31 (1): 35–42.
CAS PubMed Статья Google ученый
- 74.
Snoep JL, van der Weijden CC, Andersen HW, Westerhoff HV, Jensen PR. Суперспирализация ДНК в Escherichia coli находится под строгим и тонким гомеостатическим контролем, включая экспрессию генов и метаболическую регуляцию как топоизомеразы I, так и ДНК-гиразы. Eur J Biochem. 2002. 269 (6): 1662–9.
CAS PubMed Статья Google ученый
- 75.
Рани П., Нагараджа В. Полногеномное картирование сайтов активности топоизомеразы I показывает ее роль в сегрегации хромосом. Nucleic Acids Res. 2019; 47 (3): 1416–27.
PubMed Статья Google ученый
- 76.
Conter A, Menchon C, Gutierrez C. Роль суперспирализации ДНК и сигма-фактора rpoS в осмотической и зависимой от фазы роста индукции гена osmE из Escherichia coli K12.J Mol Biol. 1997. 273 (1): 75–83.
CAS PubMed Статья Google ученый
- 77.
Shure M, Pulleybank DE, Vinograd J. Проблемы упаковки эукариотической и прокариотической ДНК и конформации in vivo , вызванные неоднородностью плотности суперспиралей. Nucleic Acids Res. 1977; 4 (5): 1183–206.
CAS PubMed PubMed Central Статья Google ученый
- 78.
Хенгге Р. Протеолиз σ s (RpoS) и общий стрессовый ответ у Escherichia coli . Res Microbiol. 2009. 160 (9): 667–76.
CAS PubMed Статья Google ученый
- 79.
Bordes P, Conter A, Morales V, Bouvier J, Kolb A, Gutierrez C. Суперспирализация ДНК способствует отключению накопления σ s от σ s -зависимой транскрипции в Escherichia coli .Mol Microbiol. 2003. 48 (2): 561–71.
CAS PubMed Статья Google ученый
- 80.
Баттести А., Бувере Э. Взаимодействие белка-носителя ацила / SpoT, переключателя, связывающего SpoT-зависимую стрессовую реакцию с метаболизмом жирных кислот. Mol Microbiol. 2006. 62 (4): 1048–63.
CAS PubMed Статья Google ученый
- 81.
Bougdour A, Gottesman S. Регулирование ppGpp деградации RpoS через антиадаптерный белок IraP.Proc Natl Acad Sci U S. A. 2007; 104 (31): 12896–901.
CAS PubMed PubMed Central Статья Google ученый
- 82.
Лю К., Биттнер А.Н., Ван Дж.Д. Разнообразие метаболизма и эффекторов (p) ppGpp. Curr Opin Microbiol. 2015; 24: 72–9.
PubMed PubMed Central Статья CAS Google ученый
- 83.
Potrykus K, Cashel M. (p) ppGpp: все еще волшебно? Annu Rev Microbiol.2008; 62: 35–51.
CAS PubMed Статья Google ученый
- 84.
Сейфзаде М., Кинер Дж., Номура М. spoT- Зависимое накопление гуанозинтетрафосфата в ответ на голодание жирных кислот в Escherichia coli . Proc Natl Acad USA. 1993. 90 (23): 11004–8.
CAS Статья Google ученый
- 85.
Винелла Д., Альбрехт С., Кашел М., Д’Ари Р.Ограничение железа вызывает SpoT-зависимое накопление ppGpp в Escherichia coli . Mol Microbiol. 2005. 56 (4): 958–70.
CAS PubMed Статья Google ученый
- 86.
Ламонд А.И., Траверс А.А. Генетически разделяемые функциональные элементы обеспечивают оптимальную экспрессию и строгую регуляцию бактериального гена тРНК. Клетка. 1985. 40 (2): 319–26.
CAS PubMed Статья Google ученый
- 87.
Mizushima-Sugano J, Kaziro Y. Регулирование экспрессии оперона tufB : последовательности ДНК, непосредственно участвующие в строгом контроле. EMBO J. 1985; 4 (4): 1053–8.
CAS PubMed PubMed Central Статья Google ученый
- 88.
Трэверс А.А. Последовательность промотора для строгого контроля синтеза бактериальной рибонуклеиновой кислоты. J Bacteriol. 1980. 141 (2): 973–6.
CAS PubMed PubMed Central Google ученый
- 89.
Трэверс А.А., Ламонд А.И., Уикс-младший. Изменение зависимой от скорости роста регуляции экспрессии tyrT Escherichia coli посредством промоторных мутаций. J Mol Biol. 1986. 189 (1): 251–5.
CAS PubMed Статья Google ученый
- 90.
Zacharias M, Göringer HU, Wagner R. Влияние дискриминаторного мотива GCGC, введенного в рибосомную РНК P 2 — и tac , на контроль скорости роста и строгую чувствительность.EMBO J. 1989; 8 (11): 3357–63.
CAS PubMed PubMed Central Статья Google ученый
- 91.
Haugen SP, Berkmen MB, Ross W., Gaal T, Ward C, Gourse RL. Регуляция промотора рРНК путем неоптимального связывания сигма-области 1.2: дополнительный элемент распознавания для РНК-полимеразы. Клетка. 2006. 125 (6): 1069–82.
CAS PubMed Статья Google ученый
- 92.
Пембертон И.К., Мусхелишвили Г., Трэверс А.А., Бакл М. Богатая G + C дискриминаторная область промотора tyrT противодействует образованию стабильных преинициационных комплексов. J Mol Biol. 2000. 299 (4): 859–64.
CAS PubMed Статья Google ученый
- 93.
Gummesson B, Lovmar M, Nyström T. Проксимальный элемент промотора, необходимый для положительного контроля транскрипции гуанозинтетрафосфатом и белком DksA во время строгого ответа.J Biol Chem. 2013. 288 (29): 21055–64.
CAS PubMed PubMed Central Статья Google ученый
- 94.
Balke VL, Gralla JD. Изменения в связывающем числе суперспиральной ДНК сопровождают переходы роста у Escherichia coli . J Bacteriol. 1987. 169 (10): 4499–506.
CAS PubMed PubMed Central Статья Google ученый
- 95.
Се Л.С., Бургер Р.М., Дрлика К. Суперспирализация бактериальной ДНК и [АТФ] / [АДФ]. Изменения, связанные с переходом на анаэробный рост. Журнал Молекулярной биологии 1991; 219 (3): 443–450.
CAS PubMed Статья Google ученый
- 96.
Hsieh LS, Rouvière-Yaniv J, Drlica K. Суперспирализация бактериальной ДНК и соотношение [АТФ] / [АДФ]: изменения, связанные с солевым шоком. J Bacteriol. 1991. 173 (12): 3914–7.
CAS PubMed PubMed Central Статья Google ученый
- 97.
Jensen PR, Loman L, Petra B, van der Weijden C, Westerhoff HV. Энергетическая буферизация структуры ДНК не удается, когда у Escherichia coli заканчивается субстрат. J Bacteriol. 1995. 177 (12): 3420–6.
CAS PubMed PubMed Central Статья Google ученый
- 98.
Вестерхофф Х., О’Ди М., Максвелл А., Геллерт М. Суперспирализация ДНК с помощью ДНК-гиразы: анализ статической головки. Cell Biophys. 1988; 12: 157–81.
CAS PubMed Статья Google ученый
- 99.
Gutierrez JA, Csonka LN. Выделение и характеристика мутаций аденилаткиназы ( adk ) в Salmonella typhimurium , которые блокируют способность глицинбетаина действовать как осмопротектор. J Bacteriol. 1995. 177 (2): 390–400.
CAS PubMed PubMed Central Статья Google ученый
- 100.
Хиггинс К.Ф., Дорман С.Дж., Стирлинг Д.А., Уодделл Л., Бут И.Р., Мэй Дж., Бремер Э. Физиологическая роль суперспирализации ДНК в осмотической регуляции экспрессии генов в S.typhimurium и E. coli . Клетка. 1988. 52 (4): 569–84.
CAS PubMed Статья Google ученый
- 101.
Bang IS, Audia JP, Park YK, Foster JW. Автоиндукция регулятора реакции ompR кислотным шоком и контроль реакции устойчивости к кислоте Salmonella enterica . Mol Microbiol. 2002. 44 (5): 1235–50.
CAS PubMed Статья Google ученый
- 102.
Колган А.М., Куинн Х.Д., Кэри С.К., Митченолл, Лос-Анджелес, Максвелл А., Камерон АДС, Дорман С.Дж. Отрицательная суперспирализация ДНК гиразой ингибируется в Salmonella enterica serovar typhimurium во время адаптации к кислотному стрессу. Mol Microbiol. 2018; 107 (6): 734–46.
CAS PubMed Статья Google ученый
- 103.
Карем К., Фостер Дж. У. Влияние топологии ДНК на регуляцию окружающей среды pH-регулируемого локуса у Salmonella typhimurium .Mol Microbiol. 1993. 10 (1): 75–86.
CAS PubMed Статья Google ученый
- 104.
Куинн Х.Дж., Кэмерон А.Д., Дорман С.Дж. Эволюция бактериального регулона: различные ответы и роли идентичных белков OmpR Salmonella typhimurium и Escherichia coli в ответе на кислотный стресс. PLoS Genet. 2014; 10 (3): e1004215.
PubMed PubMed Central Статья CAS Google ученый
- 105.
O Cróinín T, Кэрролл Р.К., Келли А., Дорман CJ. Роль суперспирализации ДНК и белка Fis в модулировании экспрессии генов вирулентности во время внутриклеточного роста Salmonella enterica serovar typhimurium. Мол микробиол 2006; 62 (3): 869–882.
- 106.
Алиса А.Ф., Санчес-Ривас С. Суперспирализация ДНК и осморезистентность в Bacillus subtilis 168. Curr Microbiol. 1997. 35 (5): 309–15.
CAS PubMed Статья Google ученый
- 107.
Мери Дж., Кохияма М. Ионы калия и изменения суперспирализации бактериальной ДНК под действием осмотического стресса. FEMS Microbiol Lett. 1992. 78 (2–3): 159–64.
CAS PubMed Статья Google ученый
- 108.
O’Byrne CP, Ní Bhriain N, Dorman CJ. Чувствительная к сверхспирализации ДНК экспрессия оперона Salmonella typhimurium his требует аттенюатора his и модулируется анаэробиозом и осмолярностью.Mol Microbiol. 1992. 6 (17): 2467–76.
CAS PubMed Статья Google ученый
- 109.
Шихан Б.Дж., Фостер Т.Дж., Дорман СиДжей, Парк С., Стюарт Г.С. Осмотическая и зависимая от фазы роста регуляция гена eta из Staphylococcus aureus : роль в сверхспирализации ДНК. Mol Gen Genet. 1992. 232 (1): 49–57.
CAS PubMed Статья Google ученый
- 110.
Weinstein-Fischer D, Elgrably-Weiss M, Altuvia S. Escherichia coli реакция на перекись водорода: роль суперспирализации ДНК, топоизомеразы I и Fis. Mol Microbiol. 2000. 35 (6): 1413–20.
CAS PubMed Статья Google ученый
- 111.
Беббингтон К.Дж., Уильямс HD. Роль суперспирализации ДНК в регуляции цитохром bd оксидазы Escherichia coli . Микробиология. 2001. 147 (3): 591–8.
CAS PubMed Статья Google ученый
- 112.
Кэмерон А.Д., Крегер С., Куинн Х.Д., Скалли И.К., Дейли А.Дж., Кэри С.К., Дорман С.Дж. Передача сигнала доступности кислорода на промоторе Salmonella enterica serovar typhimurium fis . PLoS One. 2013; 8 (12): e84382.
PubMed PubMed Central Статья CAS Google ученый
- 113.
Cortassa S, Аон Массачусетс. Измененные активности топоизомеразы могут участвовать в регуляции суперспирализации ДНК при аэробно-анаэробных переходах в Escherichia coli . Mol Cell Biochem. 1993. 126 (2): 115–24.
CAS PubMed Статья Google ученый
- 114.
Диксон Р.А., Хендерсон NC, Остин С. Суперспирализация ДНК и аэробная регуляция транскрипции с промотора Klebsiella pneumoniae nifLA .Nucleic Acids Res. 1988. 16 (21): 9933–46.
CAS PubMed PubMed Central Статья Google ученый
- 115.
Дорман С.Дж., Барр Г.К., Ни Брайан Н., Хиггинс К.Ф. Суперспирализация ДНК и анаэробная регуляция и регуляция фазы роста экспрессии гена tonB . J Bacteriol. 1988. 170 (6): 2816–26.
CAS PubMed PubMed Central Статья Google ученый
- 116.
Малхосян СР, Панченко Я.А., Рекеш АН. Физиологическая роль суперспирализации ДНК в анаэробной регуляции экспрессии гена колицина. Mol Gen Genet. 1991. 225 (2): 342–345.
CAS PubMed Статья Google ученый
- 117.
Ямамото Н., Дроффнер М.Л. Механизмы, определяющие аэробный или анаэробный рост у факультативных анаэробов Salmonella typhimurium . Proc Natl Acad Sci U S. A. 1985; 82 (7): 2077–81.
CAS PubMed PubMed Central Статья Google ученый
- 118.
Goldstein E, Drlica K. Регулирование суперспирализации бактериальной ДНК: количество плазмидных связей меняется в зависимости от температуры роста. Proc Natl Acad Sci U S. A. 1984; 81 (13): 4046–50.
CAS PubMed PubMed Central Статья Google ученый
- 119.
Kim SH, Ganji M, Kim E, van der Torre J, Abbondanzieri E, Dekker C. Последовательность ДНК кодирует положение суперспиралей ДНК. eLife. 2018; 7: e36557.
PubMed PubMed Central Статья Google ученый
- 120.
Ахмед В., Сала С., Хегде С.Р., Джа Р.К., Коул С.Т., Нагараджа В. Транскрипция облегчила рекрутирование топоизомеразы I и ДНК-гиразы по всему геному. PLoS Genet. 2017; 13 (5): 1–20.
Артикул CAS Google ученый
- 121.
Jeong KS, Ahn J, Khodursky AB. Пространственные паттерны транскрипционной активности в хромосоме Escherichia coli . Genome Biol. 2004; 5 (11): R86.
PubMed PubMed Central Статья Google ученый
- 122.
Сутормин Д., Рубанова Н., Логачева М., Гиларов Д., Северинов К. Картирование с однонуклеотидным разрешением сайтов расщепления ДНК-гиразы в геноме Escherichia coli . Nucleic Acids Res. 2019; 47 (3): 1373–88.
PubMed Статья Google ученый
- 123.
Rafiei N, Cordova M, Navarre WW, Milstein JN. Зависимая от фазы роста конденсация хромосом и перераспределение белка H-NS в E. coli при осмотическом стрессе.bioRxiv. 2019. https://doi.org/10.1101/559138.
- 124.
Ян Й., Эймс Г.Ф. ДНК-гираза связывается с семейством прокариотических повторяющихся экстрагенных палиндромных последовательностей. Proc Natl Acad Sci U S. A. 1988. 85 (23): 8850–4.
CAS PubMed PubMed Central Статья Google ученый
- 125.
Ян Й., Эймс Г.Ф. Семейство повторяющихся экстрагенных последовательностей палиндрома: взаимодействие с ДНК-гиразой и гистоноподобным белком HU.В Бактериальная хромосома , К. Дрлика (редактор), стр. 211–225, 1990 г. Американское общество микробиологов, Вашингтон, округ Колумбия.
- 126.
Boccard F, Prentki P. Специфическое взаимодействие IHF с RIB, классом бактериальных повторяющихся элементов ДНК, расположенных на 3′-конце единиц транскрипции. EMBO J. 1993; 12 (13): 5019–27.
CAS PubMed PubMed Central Статья Google ученый
- 127.
Oppenheim AB, Rudd KE, Mendelson I, Teff D.Интеграция фактора хозяина связывается с уникальным классом сложных повторяющихся экстрагенных последовательностей ДНК в Escherichia coli . Mol Microbiol. 1993. 10 (1): 113–22.
CAS PubMed Статья Google ученый
- 128.
Nuñez JK, Bai L, Harrington LB, Hinder TL, Doudna JA. Иммунологическая память CRISPR требует специфичности фактора хозяина. Mol Cell. 2016; 62 (6): 824–33.
PubMed Статья CAS Google ученый
- 129.
Райт А.В., Лю JJ, Knott GJ, Doxzen KW, Nogales E, Doudna JA. Структуры комплекса интеграции генома CRISPR. Наука. 2017; 357 (6356): 1113–8.
CAS PubMed PubMed Central Статья Google ученый
- 130.
Corcoran CP, Dorman CJ. Зависимое от релаксации ДНК смещение фазы генетического переключателя fim в Escherichia coli зависит от взаимодействия H-NS. IHF и LRP Mol Microbiol.2009. 74 (5): 1071–82.
CAS PubMed Статья Google ученый
- 131.
Дорман С.Дж., Коркоран С.П. Топология бактериальной ДНК и инфекционное заболевание. Nucleic Acids Res. 2009. 37 (3): 672–8.
CAS PubMed Статья Google ученый
- 132.
Келли А., Конвей К. О Кройнин Т., смит С.Г., Дорман С.Дж. Суперспирализация ДНК и белок Lrp определяют направленность инверсии ДНК переключателя fim в Escherichia coli K-12.J Bacteriol. 2006; 188 (15): 5356с – 5363.
Артикул CAS Google ученый
- 133.
Радж А., ван Ауденаарден А. Природа, воспитание или случай: стохастическая экспрессия генов и ее последствия. Клетка. 2008. 135 (2): 216–26.
CAS PubMed PubMed Central Статья Google ученый
- 134.
Голдинг И., Паулссон Дж., Завильски С.М., Кокс Э.С. Кинетика активности генов у отдельных бактерий в реальном времени.Клетка. 2005. 123 (6): 1025–36.
CAS PubMed Статья Google ученый
- http://www.tcdb.org
Основная концепция: перенос генов от бактерий и вирусов может формировать сложные организмы
Когда несколько лет назад эволюционный геномик Ричард Кордо и его команда решили взглянуть на геномы загадочной группы микробов, они решили проверить Гипотеза 30-летней давности. В 1984 году французские ученые показали, что механизмы определения пола в определенной линии происхождения Armadillidium vulgare были искажены, в результате чего от 60 до 70% всех рождений были женскими (1, 2).Тем не менее, в отличие от большинства пилюльщиков, эта популяция была полностью свободна от видов эндосимбионтных бактерий, которые, как известно, искажают соотношение полов у насекомых-хозяев. Так почему же эффект перекоса все еще сохранялся?
Исследователи обнаружили, что большая часть ДНК эндосимбионтных бактерий Wolbachia интегрировалась непосредственно в хромосому пилюльки, по сути создавая совершенно новую половую хромосому посредством горизонтального переноса генов. Изображение предоставлено Ричардом Кордо.
Французская группа предположила, что бактериальная ДНК в форме плазмиды могла проникнуть в клетки насекомых, и это могло объяснить сохраняющееся бактериальное влияние.Но у группы не было геномных инструментов для проверки своей теории. В 2016 году Кордо из Университета Пуатье во Франции и его команда сообщили о потрясающем решении загадки: одна большая вставка ДНК эндосимбионтной бактерии Wolbachia интегрировалась непосредственно в хромосому пилюльки, по сути создав совершенно новую половая хромосома (3). Такой горизонтальный перенос генома от бактерий к животным иллюстрирует, говорит Кордо, значительное влияние эндосимбионтов как «агентов эволюционных изменений в системах определения пола у животных.
Бактерии хорошо известны как мастера горизонтального переноса генов среди себе подобных, быстро и беспрепятственно разделяя такие черты, как устойчивость к антибиотикам. Но недавняя работа по изучению последовательностей генома животных показала, что передача генов от бактерий многоклеточным организмам не так редка, как считалось ранее. Более того, несмотря на небольшие шансы, некоторые из этих бактериальных генов предоставили своим новым хозяевам новые и важные функции. Эти перемещения, по словам исследователей, являются недооцененным источником корма для эволюционных преобразований сложных организмов.
Горизонтальный перенос генов «определенно оказывается важным фактором эволюционной генетики и метаболического потенциала организмов», — говорит Крис Хиттингер, генетик из Университета Висконсин-Мэдисон. Хиттингер связывает это открытие с двумя факторами: во-первых, за последние несколько лет стоимость секвенирования генома резко упала. Во-вторых, исследователи стали лучше анализировать потенциальные случаи с помощью вычислений, чтобы выяснить, какие события передачи поддерживаются данными, а какие могут быть артефактами.
Теперь исследователи работают над тем, чтобы понять, насколько распространенными могут быть эти переносы, поскольку они исследуют, как бактериальным генам удается интегрироваться в клеточную среду другого и гораздо более сложного нового хозяина — иногда даже вытесняя нативные гены и функции.
Игра на удачу
По мере того, как в 2000-х годах затраты на секвенирование упали, а количество секвенируемых организмов выросло, исследователи начали обнаруживать последовательности генома, которые, по-видимому, содержали бактериальную ДНК. Обычно они связывали это с бактериальным заражением образца.Но в 2007 году ученый-геном Джули Даннинг Хотопп и ее коллеги из Медицинской школы Университета Мэриленда в Балтиморе опубликовали одни из первых доказательств того, что эти бактериальные последовательности действительно, по крайней мере в некоторых случаях, скрываются в геномах более сложных организмов ( 4).
В той ранней статье Даннинг Хотопп показал, что ДНК Wolbachia проникла в геном Drosophila . И с тех пор она показала, что у плодовых мушек довольно много ДНК Wolbachia — примерно на 5 мегабаз.Это примерно 2% генома Drosophila и более чем в три раза больше ДНК в 1,4-мегабазном геноме Wolbachia (5).
Как происходят эти переводы, до сих пор не совсем понятно. Одна из возможностей заключается в том, что процесс начинается со стрессового события, которое создает разрыв ДНК в клетке организма. Если нет интактной ДНК, которая могла бы служить шаблоном для восстановления разорванной цепи, клетка ищет любую доступную ДНК — возможно, используя близлежащую ДНК бактериальных эндосимбионтов в качестве своего рода пластыря при разрыве, объясняет исследователь Медицинского института Говарда Хьюза Хармит. Малик, генетик из Онкологического исследовательского центра Фреда Хатчинсона в Сиэтле, штат Вашингтон.«Это в значительной степени одно из тех случайных событий», — говорит Малик, изучающий генетику эволюционного конфликта.
Некоторые недавние примеры показывают, что удачливые организмы приобрели гены, которые кодируют относительно простые метаболические пути, что позволяет им использовать новый источник пищи. Например, насекомое, называемое мотыльком из кофейных ягод, приобрело ген, скорее всего, от кишечных бактерий, который кодирует фермент маннаназу, который позволяет насекомому переваривать полисахарид в кофейной ягоде (6). А паразитические нематоды многократно приобретали целлюлазы из различных источников, что позволяет им разрушать стенки растительных клеток и паразитировать на своем растении-хозяине (7).
Гены, вырабатывающие токсины, представляют собой еще один распространенный класс горизонтальных переносов. Новое исследование bioRxiv из лаборатории Ноя Уайтмана в Калифорнийском университете в Беркли показывает, что ген токсина, полученный из бактериофага, горизонтально передался дрозофилам и тлям (8). Исследователи предполагают, что насекомые используют токсин для защиты от паразитоидных ос. Хотя их собственные клетки восприимчивы к токсину, им удается использовать его так, чтобы пострадали только паразиты (как они это делают, остается загадкой).Оса-паразитоид, Nasonia vitripennis , также, по-видимому, приобрела несколько токсинов в результате горизонтального переноса генов и использует эти яды для подавления иммунитета и метаболизма своего хозяина (9). Таким образом, горизонтальный перенос генов может быть важным источником нового оружия в эскалации гонки вооружений между хозяином и паразитом.
Но некоторые из наиболее ценных и широко используемых агентов в бактериальном арсенале действительно убивают другие бактерии.
«Каким образом то, что не входило в родословную в течение сотен миллионов лет, потенциально может быть включено в инородную линию, с которой у него нет опыта? Это очень интересный вопрос.
—Ной Уайтмен
Исследование в 2014 году Wolbachia выявило древний, повторяющийся горизонтальный перенос антибактериального гена, который был внедрен множеством организмов (10). Ген кодирует лизоцим — фермент, который бактериофаг Wolbachia использует для взлома бактериальных клеток.
«Что повергло нас в полный шок и мы начали совершенно новый проект, так это то, что у этого лизоцима были гомологи по всему Древу жизни», — говорит Сет Борденштейн, микробиолог из Vanderbilt в Нашвилле, штат Теннесси, который руководил исследованием.Дело было не только в бактериофаге и Wolbachia . Это также было в таких растениях, как папоротники, и в геномах насекомых, а также в архее, живущем на дне океана рядом с гидротермальными жерлами.
В 2015 году Малик и его коллеги также обнаружили, что набор генов, кодирующих мощные антибактериальные средства, известные как эффекторные белки амидазы секреции типа VI (Tae), передавался эукариотам по крайней мере шесть раз (11). Ферменты, убивающие бактерии, эффективны против паразита, вызывающего болезнь Лайма, а приобретенные гены позволяют оленьим клещам, несущим этого паразита, производить фермент.
«Потенциал изменения жизни сложного организма в приобретении этого вида бактериального оружия очевиден», — говорит Малик. «У вас есть горизонтальный перенос генов, и внезапно у вас появляется этот готовый антибиотический механизм для защиты бактерий в вашем кишечнике».
ДНК Wolbachia проникает в геномы пилюль, плодовых мух и других видов с большей частотой, чем считалось ранее. Изображение предоставлено: Wikimedia Commons / Скотт О’Нил, лицензия CC BY 2.5.
вопреки всему
Несмотря на огромные преимущества, которые бактериальные гены могут дать более сложным организмам, шансы на передачу функционального гена по-прежнему высоки. Исследователи пытаются понять, как происходит этот огромный скачок.
Прежде чем бактериальный ген сможет работать в эукариотической клетке, ему необходимо преодолеть некоторые серьезные биологические препятствия. Он должен получить интроны, последовательность промотора и последовательность терминации. Он также должен иметь возможность плодотворно взаимодействовать с существующими генами хозяина.«Каким образом то, что было вне линии преемственности в течение сотен миллионов лет, потенциально может быть включено в чужую линию, с которой у него нет опыта? Это совершенно интересный вопрос », — говорит Уайтман.
Одним из успешных примеров является oskar , ген, который необходим и достаточен для развития зародышевой линии голометаболических насекомых. Oskar — химерный ген: половина его имеет бактериальное происхождение, а другая половина — насекомое (12, 13).Поскольку у бактерий нет функции развития зародышевой линии, химерный ген творит у насекомых что-то новое. Он также делает кое-что критически важное: без надлежащего развития зародышевой линии организм находится в эволюционном тупике.
Итак, как могут горизонтально перенесенные гены приобретать центральные, критически важные роли в своих новых хозяевах, даже заменяя важные функции хозяина, такие как определение пола эмбриона, как в случае французских пилюльщиков?
Малик подозревает, что ответ может заключаться в сильном эволюционном давлении, с которым сталкиваются эндосимбионты, чтобы изменить физиологию и развитие своего хозяина в свою пользу. Wolbachia , например, живет внутри зародышевой линии и репродуктивных тканей примерно 50% видов членистоногих в мире. Бактерии передаются потомству через яйца хозяина и разработали несколько стратегий для увеличения шансов передачи.
«Совершенно очевидно, что эндосимбиотические бактерии манипулируют зародышевой линией насекомых», — говорит Малик. «Они делают это, потому что хотят размножаться. Они живут и передаются через ооцит.Таким образом, существует множество бактерий, которые манипулировали такими вещами, как механизмы определения пола, или феминизировали генетического мужчину в женщину, как средство увеличения их передачи ».
Следовательно, гену Wolbachia не составило труда совершить функциональный скачок в геном французских пилюльщиков. « Wolbachia уже взаимодействовал с клетками пилюльки», — объясняет Кордо. «Возможно, интеграция была просто еще одним способом найти ген« феминизации ».Это также может пролить свет на то, как oskar приобрел новую и важную роль в развитии зародышевой линии голометаболических насекомых около 450 миллионов лет назад. Бактериальная половина oskar могла происходить от эндосимбионта, который манипулировал развитием зародышевой линии своего хозяина в свою пользу.
Все это помогает объяснить, как новые гены линии могут играть ключевую роль в старых процессах развития. «Раньше у нас было это догматическое представление о генах, которые действительно важны или важны — что с большой вероятностью они сохранялись с незапамятных времен, потому что, конечно, они необходимы, поэтому у нас не было бы возможности возиться с ними », — говорит Малик.«Все больше и больше работы… действительно внушают людям идею о том, что на самом деле новые гены могут быть необходимы. Фактически, молодые гены могут приобретать важные функции ».
8.4: Размножение ДНК в бактериях
Комплементация
Джордж Бидл и Эдвард Татум впервые описали концепцию, согласно которой каждый ген соответствует ферменту метаболического пути, подвергнув дрожжи Neurospora crassa мутагенным условиям (Beadle & Tatum, 1941). Следуя этим процедурам, Джошуа Ледерберг продолжил эти исследования с Татумом, где они создали два мутантных штамма Escherichia coli .Эти бактерии были ауксотрофами , неспособными вырабатывать некоторые основные питательные вещества, необходимые для поддержания их роста. Эти два штамма были описаны как met — bio — Thr + Leu + Thi + (штамм A) и Met + Bio + thr — leu — thr — leu thi — (штамм B). Штамм A может в достаточной степени синтезировать аминокислоты треонин, лейцин и кофактор тиамин, в то время как дефицит в производстве кофактора биотина и аминокислоты метионина, в то время как обратное верно для штамма B.Когда любой из этих двух штаммов помещали на минимальную среду, роста не происходило. Добавление минимальной среды метионина и биотина позволило штамму А расти как обычно. Когда два штамма были смешаны вместе и помещены на минимальную среду, наблюдался рост бактерий. Эти два штамма были способны каким-то образом дополнять друг друга, как если бы происходил половой обмен генетическим материалом (Lederberg & Tatum, 1946).
Бактерии обладают всеми необходимыми возможностями для репликации ДНК.Обычные виды бактерий адаптировали пчелы для использования в лаборатории, чтобы переносить ДНК и размножать ее для использования в биотехнологии. Помимо хромосомной ДНК бактериального генома, бактерии также имеют внехромосомную ДНК, называемую плазмидами . Эти плазмиды реплицируются независимо от бактериальной хромосомы и могут иметь высокую копию. Эти кольцевые фрагменты ДНК модифицируются в лабораториях, чтобы нести определенные фрагменты ДНК, чтобы их можно было изучать или использовать для экспрессии в белках. Плазмиды могут естественным образом нести важные черты, в том числе устойчивость к антибиотикам.Плазмиды относительно малы, их размер варьируется от 1000 до 1 000 000 баз (1–1000 КБ).
Бактериальная ДНК обычно существует в виде большой круглой хромосомы ( красный ). Плазмиды представляют собой внехромосомные и автономно реплицирующиеся фрагменты ДНК ( синий ).
Посредством процесса, называемого конъюгацией , бактерии могут «половым путем» передавать генетический материал другому, пропуская плазмиды через структуру, называемую конъюгационным пилусом .
Процесс конъюгации между донором, несущим плазмиду, и реципиентом без плазмиды. Донор создает конъюгационный пилус для создания цитозольного моста с донором, где плазмида реплицируется в реципиента посредством метода репликации по методу катящегося круга. После этого получатель получает право действовать в качестве донора.
Характеристики плазмид
плазмиды, разработанные биологами для перемещения фрагментов ДНК для исследования, называются векторами , потому что они перемещают фрагментов ДНК.
Эти плазмидные векторы имеют те же признаки, что и традиционные плазмиды, и обладают способностью к репликации независимо от бактериального генома. Функция, которая позволяет этим ДНК реплицироваться, называется точкой начала репликации (ori), которая обычно богата А и Т. Однако эти плазмидные векторы обладают дополнительными свойствами, которые позволяют легко работать с ними и отличать их от бактериальных плазмид; маркер выбора и сайт множественного клонирования.Выбор маркер обычно имеет форму гена, который кодирует устойчивость к определенному антибиотику. В изображенной плазмиде устойчивость к ампициллину обеспечивается геном β-лактамазы. Сайт множественного клонирования ( MCS ), также известный как полилинкер, представляет собой место, в котором интересующая ДНК встраивается в вектор. MCS определяются набором уникальных сайтов, где ДНК может быть разрезана эндонуклеазами рестрикции ( RE ).Как следует из названия, рестрикционные ферменты «ограничены» в своей способности разрезать или переваривать ДНК. Ограничение, которое полезно для биологов, обычно составляет палиндромных последовательностей ДНК. Палиндромные последовательности — это одна и та же последовательность вперед и назад. Некоторые примеры палиндромов: RACE CAR, CIVIC, A MAN A PLAN A CANAL PANAMA. Что касается ДНК, есть две цепи, которые идут антипараллельно друг другу. Следовательно, обратный комплемент одной цепи идентичен другой.
EcoRI образует липкие или липкие концы SmaI образует тупые концы
Рестрикционные ферменты гидролизуют ковалентные фосфодиэфирные связи ДНК, оставляя либо «липкие / когезионные», либо «тупые» концы. Это различие в разрезании важно, потому что липкий конец EcoRI можно использовать для сопоставления фрагмента ДНК, разрезанного с тем же ферментом, чтобы склеить или связать их вместе.В то время как эндонуклеазы разрезают ДНК, лигаз соединяют их вместе. ДНК, расщепленная EcoRI , может быть снова лигирована вместе с другим фрагментом ДНК, расщепленным EcoRI , но не с фрагментом, расщепленным SmaI . Другой тупой резак — EcoRV с последовательностью распознавания GAT | УВД.
«Нарезая и вставляя» ДНК в векторы, мы можем ввести чужеродную или экзогенную ДНК в бактерии. Этот тип ДНК теперь называется Рекомбинантная ДНК и является сердцем биотехнологии.
Технология рекомбинантной ДНК
Вопросы для размышления
1. Как вы думаете, почему источники репликации состоят из А и Т?
2. Чем отличаются типы связей, удерживающих двойные цепи вместе, по сравнению с фосфодиэфирными связями в основной цепи ДНК?
3. Может ли ДНК быть расщеплена SmaI лигирована с ДНК, расщепленной EcoRV ?
4.Если да, то какой фермент сможет переваривать эту новую ДНК?
2.4B: Бактериальная хромосома и нуклеоид
Цели обучения
Теперь мы рассмотрим бактериальную хромосому, расположенную в ядерной области, называемой нуклеоидом.
A. Структура и состав бактериальной хромосомы
Термин «геном» относится к сумме генетического материала организма. Бактериальный геном состоит из одной молекулы хромосомной дезоксирибонуклеиновой кислоты или ДНК и расположен в области бактериальной цитоплазмы, видимой при просмотре в электронный микроскоп, называемой нуклеоидом. В отличие от ядра эукариот, бактериальный нуклеоид не имеет ядерной мембраны или ядрышек.
В целом считается, что во время репликации ДНК каждая нить реплицирующейся бактериальной ДНК прикрепляется к белкам в том месте, которое станет плоскостью деления клетки.Например, белки Par функционируют для разделения бактериальных хромосом на противоположных полюсах клетки во время деления клетки. Они связываются с источником репликации ДНК и физически растягивают или раздвигают хромосомы, подобно митотическому аппарату эукариотических клеток (Рисунок \ (\ PageIndex {1} \)).
Рисунок \ (\ PageIndex {1} \) : Бактериальное подразделение. В целом считается, что во время репликации ДНК каждая нить реплицирующейся бактериальной ДНК прикрепляется к белкам в том месте, которое станет плоскостью деления клетки.Например, белки Par функционируют для разделения бактериальных хромосом на противоположных полюсах клетки во время деления клетки. Они связываются с источником репликации ДНК и физически растягивают или раздвигают хромосомы, подобно митотическому аппарату эукариотических клеток. В центре бактерии группа белков, называемых Fts (нитевидные термочувствительные), белки взаимодействуют, образуя кольцо в плоскости деления клетки. Эти белки образуют аппарат деления клеток, известный как дивисома, и непосредственно участвуют в делении бактериальных клеток путем бинарного деления.Дивисома отвечает за управление синтезом новой цитоплазматической мембраны и нового пептидогликана с образованием перегородки деления.В центре бактерии группа белков, называемых Fts (нитевидные термочувствительные), белки взаимодействуют, образуя кольцо в плоскости деления клетки. Эти белки образуют аппарат деления клеток, известный как дивисома, и непосредственно участвуют в делении бактериальных клеток путем бинарного деления. Дивисома отвечает за управление синтезом новой цитоплазматической мембраны и нового пептидогликана с образованием перегородки деления.
Поскольку бактерии гаплоидны, то есть они имеют только одну хромосому и размножаются только бесполым путем, у бактерий также нет мейоза.
Бактериальная хромосома представляет собой одну длинную одиночную молекулу двухцепочечной спиральной суперспиральной ДНК. У большинства бактерий два конца двухцепочечной ДНК ковалентно связываются вместе, образуя как физический, так и генетический круг. Хромосома обычно имеет длину около 1000 мкм и часто содержит до 3500 генов (рисунок \ (\ PageIndex {2} \)). E . coli , бактерия длиной 2–3 мкм, имеет хромосому длиной около 1400 мкм.
Рисунок \ (\ PageIndex {2} \) : Электронная микрофотография бактериальной хромосомыЧтобы макромолекула такого размера могла поместиться внутри бактерии, гистоноподобные белки связываются с ДНК, разделяя молекулу ДНК примерно на 50 частей. хромосомные домены и делая его более компактным. Фермент ДНК-топоизомераза, называемый ДНК-гиразой, затем суперспирает каждый домен вокруг себя, образуя компактную массу ДНК приблизительно 0.Диаметр 2 мкм. У активно растущих бактерий выступы нуклеоида простираются в цитоплазму. Предположительно, эти выступы содержат ДНК, которая транскрибируется в мРНК. Сверхциклы вставляются и удаляются топоизомеразой .
ДНК-топоизомеразы, следовательно, необходимы для раскручивания, репликации и перемотки кольцевой сверхспиральной бактериальной ДНК. Чтобы длинная молекула ДНК поместилась внутри бактерии, ДНК должна быть суперспиральной. Однако эта сверхспиральная ДНК должна быть развернута и расслаблена, чтобы ДНК-полимераза могла связываться для репликации ДНК, а РНК-полимераза — для связывания для транскрипции ДНК.Например, топоизомераза, называемая ДНК-гиразой, катализирует отрицательную суперспирализацию кольцевой ДНК, обнаруживаемой у бактерий. С другой стороны, топоизомераза IV участвует в релаксации суперспиральной кольцевой ДНК, обеспечивая разделение взаимосвязанных дочерних хромосом в конце репликации бактериальной ДНК.
B. Репликация ДНК в бактериях
В общем, ДНК реплицируется путем раскручивания спирали, разделения цепей путем разрыва водородных связей между комплементарными цепями и синтеза двух новых цепей путем спаривания комплементарных оснований.Репликация начинается в определенном участке ДНК, который называется ориджином репликации ( ori C).
Рисунок \ (\ PageIndex {3} \) : Репликация ДНК путем комплементарного спаривания оснований: раскручивание ДНК-геликазой. Репликация начинается в определенном участке ДНК, который называется точкой начала репликации. Разматывающие ферменты, называемые ДНК-геликазами, заставляют две родительские цепи ДНК раскручиваться и отделяться друг от друга в обоих направлениях на этом участке, образуя две Y-образные вилки репликации.Эти репликационные вилки и являются фактическим местом копирования ДНК. Во время репликации внутри вилки дестабилизирующие спираль белки (здесь не показаны) связываются с одноцепочечными областями, предотвращая повторное соединение цепей. Репликация ДНКявляется двунаправленной от точки начала репликации. Чтобы начать репликацию ДНК, раскручивающие ферменты, называемые ДНК-геликазами, заставляют короткие сегменты двух родительских цепей ДНК раскручиваться и отделяться друг от друга в точке начала репликации с образованием двух Y-образных вилок репликации.Эти вилки репликации и являются фактическим местом копирования ДНК (Рисунок \ (\ PageIndex {3} \)). Все белки, участвующие в репликации ДНК, объединяются в ответвлениях репликации с образованием репликационного комплекса, называемого реплисомой (рис. \ (\ PageIndex {4} \)).
Рисунок \ (\ PageIndex {4} \) : Двунаправленная кольцевая репликация ДНК у бактерий. Репликация ДНК (стрелки) происходит в обоих направлениях от точки начала репликации в кольцевой ДНК, обнаруженной у большинства бактерий. Все белки, участвующие в репликации ДНК, объединяются в ответвлениях репликации с образованием репликационного комплекса, называемого реплисомой.Отстающая цепь ДНК выходит из ведущей цепи, и это позволяет реплисоме перемещаться вдоль обеих цепей, протягивая ДНК по мере того, как происходит репликация. Это настоящая ДНК, а не ДНК-полимераза, которая движется во время репликации бактериальной ДНК.Одноцепочечные связывающие белки связываются с одноцепочечными областями, поэтому две цепи не соединяются повторно. При раскручивании двухцепочечной спирали образуются положительные суперспирали перед вилкой репликации. Ферменты, называемые топоизомеразами , противодействуют этому, создавая разрывы в ДНК, а затем воссоединяются с ними, образуя отрицательные суперспирали, чтобы снять этот стресс в спиральной молекуле во время репликации.
По мере того, как цепи продолжают раскручиваться и разделяться в обоих направлениях вокруг всей молекулы ДНК, новые комплементарные цепи образуются за счет водородных связей свободных нуклеотидов ДНК с нуклеотидами на каждой родительской цепи. Поскольку новые нуклеотиды выстраиваются в линию напротив каждой родительской цепи за счет водородных связей, ферменты, называемые ДНК-полимеразами, присоединяются к нуклеотидам посредством фосфодиэфирных связей. Фактически, нуклеотиды, выстраивающиеся путем комплементарного спаривания оснований, представляют собой дезоксинуклеотидтрифосфаты, состоящие из азотистого основания, дезоксирибозы и трех фосфатов.Поскольку фосфодиэфирная связь образуется между 5′-фосфатной группой нового нуклеотида и 3′-ОН последнего нуклеотида в цепи ДНК, два фосфата удаляются, обеспечивая энергию для связывания (см. Рисунок \ (\ PageIndex {6} \) )). В конце концов, каждая родительская цепь служит шаблоном для синтеза комплементарной копии самой себя, в результате чего образуются две идентичные молекулы ДНК (см. Рисунок \ (\ PageIndex {7} \)). В бактериях Par-белки разделяют бактериальные хромосомы на противоположные полюса клетки во время деления клетки.Они связываются с источником репликации ДНК и физически растягивают или раздвигают хромосомы, подобно митотическому аппарату эукариотических клеток. Белки Fts, такие как FtsK в дивисоме, также помогают в разделении реплицированной бактериальной хромосомы.
GIF-анимация, иллюстрирующая репликацию ДНК путем комплементарного спаривания оснований
На самом деле репликация ДНК более сложна из-за природы ДНК-полимераз. Ферменты ДНК-полимеразы способны только присоединить фосфатную группу на 5′-углеродном атоме нового нуклеотида к гидроксильной (ОН) -группе 3′-го атома углерода нуклеотида, уже находящегося в цепи.В результате ДНК может быть синтезирована только в направлении от 5 ‘до 3’ при копировании родительской цепи, идущей в направлении от 3 ‘до 5’.
Каждая цепь ДНК имеет два конца. 5′-конец ДНК — это конец с концевой фосфатной группой на 5′-углеродном атоме дезоксирибозы; 3 ‘конец — это конец с концевой гидроксильной (ОН) группой на дезоксирибозе 3’ углерода дезоксирибозы (см. рисунок \ (\ PageIndex {8} \)). Две нити антипараллельны, то есть они идут в противоположных направлениях. Следовательно, одна родительская нить — та, которая проходит от 3 ‘до 5’ и называется ведущей цепью — может быть скопирована прямо по всей ее длине (см. Рисунок \ (\ PageIndex {9} \)).Однако другая родительская цепь — одна, идущая от 5 ‘до 3’ и называемая отстающей цепью, должна прерывисто копироваться короткими фрагментами (фрагментами Окадзаки) примерно по 100-1000 нуклеотидов каждый по мере раскручивания ДНК. Это происходит, как упоминалось выше, на реплисоме. Отстающая цепь ДНК выходит из ведущей цепи, и это позволяет реплисоме перемещаться вдоль обеих цепей, протягивая ДНК по мере того, как происходит репликация. Это настоящая ДНК, а не ДНК-полимераза, которая движется во время репликации бактериальной ДНК (см. Рисунок \ (\ PageIndex {5} \)).
Кроме того, ферменты ДНК-полимеразы не могут начать новую цепочку ДНК с нуля. Они могут присоединять новые нуклеотиды только к 3′-ОН-группе нуклеотида в уже существующей цепи. Следовательно, чтобы начать синтез ведущей цепи и каждого фрагмента ДНК отстающей цепи, требуется комплекс РНК-полимеразы, называемый примазой. Примаза, которая способна присоединяться к нуклеотидам РНК, не требуя наличия уже существующей цепи нуклеиновой кислоты, сначала добавляет несколько дополнительных нуклеотидов РНК напротив нуклеотидов ДНК на родительской цепи.Это формирует так называемый праймер РНК (см. Рисунок \ (\ PageIndex {10} \)).
ЗатемДНК-полимераза III заменяет примазу и может добавлять нуклеотиды ДНК к праймеру РНК (см. Рисунок \ (\ PageIndex {11} \)). Позже ДНК-полимераза II расщепляет праймер РНК и заменяет нуклеотиды РНК праймера соответствующими нуклеотидами ДНК, чтобы заполнить пробел (см. Рисунок \ (\ PageIndex {12} \)). Наконец, сами фрагменты ДНК соединяются ферментом ДНК-лигазой (см. Рисунок \ (\ PageIndex {9} \)).Но даже с помощью этой сложной процедуры макромолекула плотно упакованной сверхспиральной ДНК длиной 1000 микрометров может сделать точную копию себя всего за 10 минут при оптимальных условиях, вставляя нуклеотиды со скоростью около 1000 нуклеотидов в секунду!
YouTube-ролик, иллюстрирующий репликацию ДНК в прокариотических клетках, №1. |
YouTube-ролик, иллюстрирующий репликацию ДНК в прокариотических клетках, №2. |
GIF-анимация, иллюстрирующая репликацию ведущих и отстающих цепей ДНК |
Предоставлено HHMI’s Biointeractive. |
Для получения дополнительной информации: Обзор репликации прокариотической ДНК из блока 7 |
С.Функции бактериальной хромосомы
Хромосома — это генетический материал бактерии. Гены, расположенные вдоль ДНК, транскрибируются в молекулы РНК, в первую очередь информационную РНК (мРНК), транспортную РНК (тРНК и рибосомную РНК (рРНК). Затем матричная РНК транслируется в белок на рибосомах.
В общем, ДНК определяет, какие белки и ферменты может синтезировать организм и, следовательно, какие химические реакции он способен проводить.
D. Бактериальный эпигеном
Эпигеном относится к разнообразным химическим соединениям, которые модифицируют геном, как правило, путем добавления метильной (CH 3 ) группы к аденину нуклеотидного основания в определенных местах молекулы ДНК.Это метилирование может, в свою очередь, либо подавлять, либо активировать транскрипцию определенных генов. По сути, включая или выключая гены, эпигеном позволяет бактериальному геному взаимодействовать с окружающей бактерией и реагировать на нее. Эпигеном может передаваться по наследству так же, как и геном.
Все клетки, включая клетки человека, обладают эпигеномом. Так же, как бактериальный эпигеном может влиять на бактериальный геном, бактерии могут влиять на наш эпигеном и впоследствии изменять функцию нашего генома, вызывая метилирование нуклеотидов ДНК или модифицируя наши гистоновые белки.Полученная модификация может либо помочь активировать различные гены, участвующие в иммунной защите, либо, в случае некоторых патогенов, подавить гены иммунного ответа.
E. Значение хромосомы в инициации защиты организма
Чтобы защитить себя от инфекции, организм должен сначала обнаружить присутствие микроорганизмов. Организм делает это, распознавая молекулы, уникальные для микроорганизмов, которые не связаны с клетками человека. Эти уникальные молекулы называются молекулярными структурами, ассоциированными с патогенами, или PAMPS.(Поскольку все микробы, а не только патогенные микробы, обладают PAMP, молекулярные структуры, связанные с патогенами, иногда называют молекулярными структурами, связанными с микробами, или MAMP.)
Бактериальные и вирусные геномы с высокой частотой содержат неметилированные динуклеотидные последовательности цитозин-гуанина (CpG) (цитозин, лишенный метильной группы или группы CH 3 и расположенный рядом с гуанином). ДНК млекопитающих имеет низкую частоту цитозин-гуаниновых динуклеотидов, и большинство из них метилировано. Эти неметилированные цитозин-гуаниндинуклеотидные последовательности в бактериальной ДНК представляют собой PAMPS, которые связываются с рецепторами распознавания образов на различных защитных клетках организма и запускают врожденные иммунные защиты, такие как воспаление, лихорадка и фагоцитоз.
F. Противомикробные агенты, ингибирующие нормальную репликацию нуклеиновых кислот в бактериях
Некоторые антибактериальные химиотерапевтические препараты действуют на бактерии, подавляя нормальную репликацию нуклеиновых кислот.
Антимикробная химиотерапия будет более подробно рассмотрена позже в Блоке 2 «Контроль бактерий с помощью антибиотиков и дезинфицирующих средств».
Упражнение: подумайте, попробуйте и поделитесь вопросами
Как мы узнаем, молекулярные паттерны, связанные с патогенами (PAMP), представляют собой микробные молекулы, общие для многих микробов, но не присутствующие в составе человеческого тела и способные инициировать врожденные иммунные реакции.Примеры на данный момент включают фрагменты пептидогликана, липополисахарид в грамотрицательной клеточной стенке и липотейхоевые кислоты в грамположительной клеточной стенке, молекулы, которых не хватает человеческим клеткам. Бактериальные и вирусные геномы также действуют как PAMP.
В наших клетках также есть ДНК и РНК. Как бактериальные и вирусные геномы могут инициировать врожденный иммунитет, когда наши геномы этого не делают?
Сводка
Вопросы
Изучите материал этого раздела, а затем запишите ответы на эти вопросы. Не просто нажимайте на ответы и записывайте их. Это не будет проверять ваше понимание этого руководства.
Авторы и авторство
Суперспирализация ДНК и транскрипция в бактериях: улица с двусторонним движением | BMC Molecular and Cell Biology
Границы | Втягивать и выталкивать: механизмы горизонтального переноса генов в бактериях
Введение
Горизонтальный перенос генов (HGT) стимулирует эволюцию бактерий. Перенос генов устойчивости к антибиотикам (ARG) играет важную роль в развитии множественной лекарственной устойчивости (МЛУ) у бактерий (Forsberg et al., 2012). В природе существует три «классических» метода переноса ДНК: бактериальная конъюгация, естественная трансформация и трансдукция (von Wintersdorff et al., 2016). Посредством HGT экзогенная ДНК может передаваться от одной бактерии к другой, даже если они имеют лишь отдаленное родство (Chen et al., 2005; Burton and Dubnau, 2010). Благодаря накоплению генов, участвующих в различных механизмах устойчивости экзогенной ДНК, бактерии могут быстро приобретать МЛУ. Например, штаммы Acinetobacter и Enterobacter , несущие плазмиду NDM-1 или mcr-1 , которые содержат группу генов устойчивости, могут переносить антибиотики даже в крайнем случае (Yong et al., 2009; Ван и Сан, 2015; Лю и др., 2016; Шен и др., 2016; Zheng et al., 2017). Понимание механизмов передачи ДНК в бактериях предоставит новые стратегии, которые помогут решить текущую проблему бактерий с множественной лекарственной устойчивостью в будущем.
Естественная бактериальная трансформация и конъюгация были обнаружены у бактерий и архей. Два разных мембранных белковых комплекса, состоящие из консервативных белков, отвечают за втягивание и выталкивание ДНК во время естественной бактериальной трансформации и конъюгации, соответственно (Chen and Dubnau, 2004; Claverys et al., 2009; Бертон и Дубнау, 2010; Johnston et al., 2014; Кабезон и др., 2015; Илангован и др., 2015, 2017). Эти транспортные системы ДНК доставляют одноцепочечную ДНК (оцДНК) либо из клетки-донора (для конъюгации), либо в клетку-реципиент (для трансформации) (Chen and Dubnau, 2004; Claverys et al., 2009; Burton and Dubnau, 2010; Johnston et al., 2014; Cabezon et al., 2015; Ilangovan et al., 2015, 2017). Недавние исследования выявили два новых типа переноса ДНК в Escherichia coli .Было показано, что один из этих методов не зависит от консервативных белков для транспорта оцДНК во время естественной трансформации или бактериальной конъюгации. Вместо этого двухцепочечная ДНК (дцДНК) захватывается цитоплазмой и интернализуется клетками E. coli на пластинах с твердым агаром (Sun et al., 2006, 2009, 2013; Sun, 2011, 2016; Zhang et al. , 2012). Другой метод переноса ДНК зависит от контакта клетки с клеткой, и перенос ДНК происходит внутри колонии на чашках с агаром (Maeda et al., 2004, 2006; Etchuuya et al., 2011; Собуэ и др., 2011; Куроно и др., 2012; Мацуда и др., 2012; Мацумото и др., 2016). Перенос ДНК с помощью этого метода чувствителен к ДНКазе I, что указывает на то, что ДНК, которая транспортируется в клетку-реципиент, является обнаженной (а не защищенной белком). Хотя перенос ДНК происходит на чашках с агаром с помощью обоих из двух вышеупомянутых методов трансформации, никаких доказательств сходства между механизмами переноса ДНК этими двумя методами нет. В первом методе трансформации перенос ДНК происходит в отсутствие донорских клеток.Тогда как в последнем методе трансформации донорские клетки необходимы для переноса ДНК в колонии. Во время бактериальной конъюгации необходим физический контакт между донорскими и реципиентными клетками. Тем не менее, зависимая от контакта клетка трансформация плазмиды отличается от конъюгации тем, что перенос ДНК не опосредуется мобильными элементами (Maeda et al., 2004; Kurono et al., 2012; Matsuda et al., 2012). В этом обзоре мы сначала обсудим механизмы классической естественной бактериальной трансформации и конъюгации.Затем будет подробно описан перенос неканонической ДНК на чашки с агаром, с акцентом на то, как ДНК втягивается в клетки.
Втягивание ДНК во время естественной трансформации
Естественная трансформация была обнаружена у Streptococcus pneumoniae в 1928 году (Griffith, 1928). Индуцированные гептадекапептидным феромоном, естественно трансформируемые бактерии демонстрируют особое физиологическое состояние, называемое «компетенцией», во время которого они способны втягивать экзогенную ДНК (Berka et al., 2002; Огура и др., 2002). Механизм переноса ДНК во время естественной трансформации хорошо сохраняется среди грамположительных (G + ) (например, Bacillus subtilis и S. pneumoniae ) и грамотрицательных (G — ) видов бактерий (например, Neisseria gonorrhoeae , Haemophilus influenzae и Vibrio cholerae ), а также архей (Chen, Dubnau, 2004; Claverys et al., 2009; Burton and Dubnau, 2010; Johnston et al., 2014; Cabezon et al., 2014; Cabezon et al., 2014; Cabezon et al., 2014; Cabezon et al., 2014; Cabezon et al. al., 2015; Илангован и др., 2015, 2017; Вининг и Блокеш, 2017). Хотя условия для индукции компетентности широко различаются среди видов бактерий (Aas et al., 2002; Berka et al., 2002; Claverys et al., 2006; Veening and Blokesch, 2017), белки, участвующие в захвате ДНК, высоко консервативны даже среди отдаленных друг от друга. родственные бактерии (Johnston et al., 2014), за исключением Helicobacter pylori , который использует систему, подобную конъюгации, для поглощения ДНК во время естественной трансформации (Smeets and Kusters, 2002).Здесь описана консервативная система захвата ДНК у бактерий.
G — бактерии имеют наружную мембрану (OM), а бактерии G + — нет. Во время естественной трансформации бактериям G — необходимо протягивать ДНК как через ОМ, так и через внутреннюю мембрану (IM), тогда как бактериям G + необходимо преодолевать барьер пептидогликанового слоя, который намного толще и плотнее и требует быть ослабленным перед перемещением ДНК через IM. В этом процессе дцДНК протягивается через ОМ у бактерий G — , а оцДНК протягивается через IM как у бактерий G + , так и у G — бактерий.Общий механизм, лежащий в основе переноса ДНК во время естественной трансформации, представлен на Рисунке 1.
РИСУНОК 1. Классический захват ДНК во время естественной трансформации. Экзогенная ДНК втягивается в цитоплазму за счет расширения и ретракции псевдопилей, как следствие сборки и разборки мультимеров псевдопилина (PilA). За этим следует перенос дцДНК через белок ОМ PilQ / HofQ (только для бактерий G –). Рецептор ДНК (ComEA) опосредует перенос одной цепи ДНК через канал IM, образованный ComEC, с помощью АТФазы ComFA, сопровождаемый деградацией другой цепи ДНК.Входящая оцДНК защищена DprA, который передает ее RecA для гомологичной рекомбинации в цитоплазме.
Переходя OM
Для бактерий G — сложный белковый комплекс собирается в ОМ, где этот комплекс связывает экзогенную ДНК и переносит ее в периплазму (рис. 1). Сборка и разборка ворсинок типа IV вызывает вытеснение волоконоподобных псевдопилусов и их вытягивание обратно в порообразующие белки OM (Chen and Dubnau, 2004).Пора, которая вмещает экзогенную ДНК, имеет диаметр 6–6,5 нм и образована PilQ, секретином шириной 15 нм и длиной 34 нм с пятью кольцами и необычайно стабильными структурами «конуса» и «чашечки» (Chen and Dubnau , 2004). Полость поры достаточно велика для размещения дцДНК (~ 2,4 нм) (Collins et al., 2001; Assalkhou et al., 2007; Burkhardt et al., 2011). Сопровождаясь удлинением и сокращением пилей IV типа, ДНК транспортируется через ОМ через поры (Laurenceau et al., 2013; Salzer et al., 2014, 2016; Леонг и др., 2017). Между OM и IM (периплазма) поступающая ДНК связана с субстрат-связывающим белком ComEA, который предотвращает скольжение ДНК посредством механизма «броуновского храпового механизма» (Inamine and Dubnau, 1995; Provvedi and Dubnau, 1999; Berge et al., 2002; Takeno et al., 2012; Seitz et al., 2014; Salzer et al., 2016).
Переход IM
Связанная ComEA в периплазме, экзогенная ДНК перемещается через IM через поры, образованные ComEC, также называемые Rec2 у некоторых бактерий G — (например,g., H. influenzae ), широко консервативный белок IM для транслокации ДНК через IM (Barouki and Smith, 1985; Berge et al., 2002; Draskovic and Dubnau, 2005; Sinha et al., 2012; Baker et al., 2016; Salzer et al., 2016). Было высказано предположение, что ComEC действует как транслоказа и как нуклеаза во время транслокации ДНК (Chen, Dubnau, 2004; Claverys et al., 2009; Burton, Dubnau, 2010; Johnston et al., 2014; Veening and Blokesch, 2017). В этом процессе одна цепь дцДНК перемещается в цитоплазму, одновременно происходит деградация другой цепи (Barouki and Smith, 1985; Berge et al., 2002; Baker et al., 2016). In silico анализ ComEC показывает, что β-лактамазоподобный домен на С-конце может функционировать как нуклеаза, а домен с неизвестной функцией 4131 на N-конце имеет ДНК-связывающий домен (Baker et al., 2016) . Возможно, что дцДНК, которая связана с N-концом ComEC, разделена на две цепи оцДНК, и одна из них расщепляется нуклеазой на С-конце.
Предполагается, что канал транслокации ДНК образован двумя мономерами ComEC с семью трансмембранными сегментами (Draskovic and Dubnau, 2005).Учитывая, что сверхэкспрессия ComEC токсична для клетки, структура ComEC остается нерешенной (Draskovic and Dubnau, 2005). Движущей силой транслокации оцДНК через IM может быть АТФаза (ComFA), которая также широко консервативна у бактерий (Londono-Vallejo and Dubnau, 1994; Takeno et al., 2011; Chilton et al., 2017; Diallo et al., 2017). После транслокации оцДНК, DprA и RecA связывают оцДНК и катализируют образование объединенных молекул ДНК для гомологичной рекомбинации (Mortier-Barriere et al., 2007; Dwivedi et al., 2013; Ядав и др., 2013, 2014; Даффин и Барбер, 2016; Diallo et al., 2017; Hovland et al., 2017; Le et al., 2017). Таким образом, входящая чужеродная оцДНК замещает одну цепь хромосомной дцДНК (Mortier-Barriere et al., 2007) с последующим преобразованием в гомогенную дцДНК посредством репликации ДНК.
Перенос ДНК во время конъюгации бактерий
Бактериальная конъюгация была впервые обнаружена у E. coli (Lederberg and Tatum, 1946).Опираясь на межклеточный контакт, ДНК может выталкиваться из клетки-донора и транспортироваться в клетку-реципиент во время конъюгации бактерий. Группа модульных мобильных генетических элементов, известных как интегративные и конъюгативные элементы (ICEs) или конъюгативные транспозоны (Franke and Clewell, 1981), была обнаружена во многих бактериальных геномах (Wozniak and Waldor, 2010; Bi et al., 2012; Cury и др., 2017). ICE могут передаваться от одной бактерии к другой, облегчая распространение ARG в окружающей среде (Wozniak and Waldor, 2010; Bi et al., 2012; Cury et al., 2017). Передача конъюгированной ДНК через мембрану бактерии-донора зависит от большого мембранно-ассоциированного белкового комплекса, который принадлежит к системе секреции типа IV (T4SS) (Goessweiner-Mohr et al., 2013; Cabezon et al., 2015; Ilangovan et al., 2015; рисунок 2). Компоненты T4SS для конъюгации кодируются генами либо самовоспроизводящихся конъюгативных плазмид, либо ICE в хромосомной ДНК бактерии-донора (Cabezon et al., 2015; Ilangovan et al., 2015; Johnson and Grossman, 2015).Механизм передачи ДНК представлен на Рисунке 2.
РИСУНОК 2. Перенос ДНК во время бактериальной конъюгации. Конъюгативная ДНК преобразуется в оцДНК релаксазой (R) в цитоплазме бактерии-донора. Для дальнейшего транспорта оцДНК группа мембранных и периплазматических белков собирается вместе, чтобы сформировать большой комплекс, который можно подразделить на четыре отдельные части: (1) пилус формируется путем сборки пилинов (VirB2) с адгезинами (VirB5). на дистальном конце; (2) компонент OM, который состоит из VirB7, VirB9 и С-конца VirB10; (3) периплазматический компонент, состоящий из VirB8, VirB10 и VirB6; и (4) компонент IM, состоящий из VirB3, VirB6, VirB8 и VirB10.Кроме того, три гексамерных АТФазы (VirB4, VirB11 и VirD4) присоединены к IM для обеспечения энергии во время передачи ДНК.
Покрытая белком конъюгативная оцДНК транспортируется через IM, периплазму и OM через мембранный канал, образованный группой белков, кодируемых молекулой конъюгированной ДНК (Goessweiner-Mohr et al., 2013; Cabezon et al., 2015; Ilangovan et al. др., 2015). Внутри канала конъюгативная ворсинка (образованная пилинами) отвечает за выталкивание оцДНК из мембраны.Механизм передачи ДНК посредством конъюгации лучше всего иллюстрируется системой Vir. Чтобы экспортировать ДНК из донорской клетки, конъюгированная плазмида кодирует сложный мембранный белковый комплекс. Во время конъюгации релаксаза, кодируемая плазмидой или ICE, создает разрыв в одной цепи конъюгативной ДНК на сайте oriT , после чего следует транслокация оцДНК через канал, образованный компонентами T4SS, и репликация оставшейся цепи либо независимо друг от друга. от конъюгации или совместно с ней (Ilangovan et al., 2017). Во время транслокации через клеточные мембраны три АТФазы (VirD4, VirB4 и VirB11) обеспечивают энергию для транспорта ДНК (Chen et al., 2005; Cabezon et al., 2015; Ilangovan et al., 2015). При естественной трансформации и конъюгации разные типы пилей участвуют в движении ДНК. Компетентные пили или псевдопили опосредуют перенос дцДНК через мембрану во время естественной трансформации, тогда как конъюгативные пили опосредуют перенос оцДНК через мембрану во время конъюгации (Cabezon et al., 2015; Илангован и др., 2015). В обоих случаях сборка / разборка пилей приводит в движение переносящуюся ДНК. Остается неясным, как конъюгированная ДНК далее транспортируется в клетке-реципиенте.
Поглощение дцДНК в
E. coliE. coli долгое время считалось не поддающимся естественному преобразованию. В этом столетии естественная трансформация E. coli наблюдалась сначала на пластинах с агаром с дефицитом питательных веществ, а затем на пластинах с богатым питательными веществами агаром (Tsen et al., 2002; Sun et al., 2006). Хотя естественная плазмидная трансформация E. coli демонстрирует кинетику однократного попадания, подразумевая, что дцДНК может проникать в клетку (Sun et al., 2009), существуют основные различия между естественной и химической трансформацией. Во-первых, естественной трансформации способствует повышенная концентрация агара, тогда как химическая трансформация зависит от высоких концентраций двухвалентных ионов (например, Ca 2+ , Mg 2+ или Mn 2+ ) (Sun et al. , 2009). Однако стимулирующее действие агара на трансформацию не связано с увеличением концентрации Ca 2+ , Mg 2+ или Mn 2+ (Sun et al., 2009). Остается неясным, способствуют ли осмотическое давление и / или какой-либо другой биологический / физический фактор (-ы) увеличению трансформации на чашках с высокой концентрацией агара. Во-вторых, белок OM, OmpA, играет противоположные роли в естественной и химической трансформации E. coli : он способствует химической трансформации, но подавляет естественную трансформацию (Sun et al., 2013). В-третьих, экспоненциально растущие клетки E. coli часто используются для получения химически компетентных клеток с наивысшей эффективностью, и химическое преобразование происходит в жидкости, тогда как естественное преобразование стационарной фазы E.coli регулируется регулятором транскрипции RpoS и циклическим AMP (цАМФ) — рецепторным белком цАМФ (CRP), и эти клетки могут приобретать экзогенную ДНК исключительно на чашках с агаром (Zhang et al., 2012; Guo et al., 2015 ). Функции RpoS или комплекса цАМФ-CRP в химической трансформации E. coli не обнаружены.
Естественная трансформация E. coli также отличается от трансформации других естественно трансформируемых бактерий тем, что консервативный механизм поглощения ДНК не требуется для поглощения экзогенной дцДНК в E.coli (Sun et al., 2009). Считается, что некоторые компоненты консервативного механизма захвата ДНК функционируют при использовании ДНК в качестве питательного вещества в E. coli (Finkel and Kolter, 2001; Palchevskiy and Finkel, 2006). Тем не менее попытки подтвердить эти наблюдения в трех независимых лабораториях не увенчались успехом (Sun, 2011; Johnston et al., 2014). ДНК, которая считалась единственным источником углерода, не могла объяснить рост клеток, а это означает, что в культуре должны присутствовать другие источники питательных веществ (Sun, 2011; Johnston et al., 2014). Возможно, что деградированная ДНК в минимальной культуре служит источником строительных блоков для синтеза новой ДНК в бактериях. Было показано, что во время естественной трансформации E. coli новые белки-переносчики ABC участвуют в переносе ДНК (Sun et al., 2009; Sun, 2016). Эти переносчики отличаются от известных классических белков захвата ДНК, которые опосредуют естественную бактериальную трансформацию. Механизм этого нового типа передачи ДНК представлен на рисунке 3.
РИСУНОК 3. Новый путь переноса дцДНК в Escherichia coli . Через неидентифицированный канал экзогенная ДНК передается через ОМ. Порообразующий белок OmpA может конкурировать за ДНК с неидентифицированным каналом. Чтобы пройти через IM, входящая ДНК связывает субстрат-связывающий белок YdcS и перемещается из периплазмы в цитоплазму через канал IM, образованный YdcV. Остается неясным, входит ли плазмида в E. coli в виде интактной кольцевой или линейной дцДНК.
Переходя OM
Escherichia coli имеет полный набор генов, которые потенциально кодируют компоненты классического механизма захвата ДНК. Эти гены гомологичны консервативным генам захвата ДНК у других естественно трансформируемых бактерий. Сравнительный геномный анализ предсказывает, что в E. coli предполагаемые гены захвата ДНК hofQ и gspD могут кодировать белки, образующие канал для транспортировки ДНК через OM, а ppdD может кодировать пилины для сборки компетентности. pili или pseudopili, которые притягивают экзогенную ДНК (Finkel and Kolter, 2001; Claverys, Martin, 2003; Sun et al., 2009). Однако инактивация hofQ , gspD или ppdD не влияет на естественную трансформацию дцДНК, предполагая, что консервативный механизм захвата ДНК для транслокации оцДНК не опосредует перенос дцДНК через ОМ в E. coli ( Sun et al., 2009). Чтобы идентифицировать поры ОМ, используемые для транспорта ДНК во время естественной трансформации E. coli , оценивали порообразующий белок OmpA, учитывая, что OmpA выполняет функции при инфицировании бактериофагом и конъюгации бактерий.Инактивация ompA увеличивает естественную трансформацию в 7-60 раз, снижая химическую трансформацию примерно в 10 раз, предполагая, что OmpA блокирует перенос ДНК во время естественной трансформации, но способствует передаче ДНК при искусственной трансформации (Sun et al., 2013). Маловероятно, что OmpA образует открытые ворота в естественных условиях, но может быть переключен в открытое состояние с помощью молекулярной силы электростатического взаимодействия (то есть солевого мостика), которая управляет структурным переходом белка в различных условиях (Hong et al., 2006). Закрытое и открытое состояния ворот зависят от образования солевых мостиков Arg138-Glu52 и Lys82-Glu128, соответственно (Hong et al., 2006). Во время естественной трансформации E. coli ДНК может проходить через неидентифицированный канал, который конкурирует с OmpA за трансформацию ДНК. Предполагаемый канал может состоять из компонентов ОМ (т.е. белка ОМ и пилей / пседопилей) транспортной системы ДНК и втягивает ДНК в клетку на пластине с LB-агаром. В состоянии по умолчанию «ворота закрыты» OmpA улавливает трансформирующуюся ДНК, не позволяя ей достичь нужного канала для завершения трансформации.Напротив, во время химической трансформации или электропорации высокая концентрация Ca 2+ или электрический ток помогает открыть ворота, позволяя ДНК проходить через канал, образованный OmpA (Sun et al., 2013).
Переход IM
На основании исследования топологии мембраны предсказано, что консервативный белок IM, называемый ComEC, опосредует транслокацию оцДНК во время классической естественной трансформации (Chen and Dubnau, 2004; Claverys et al., 2009; Johnston et al., 2014).Однако инактивация гомолога ComEC YcaI в E. coli не влияет на естественную плазмидную трансформацию E. coli , что позволяет предположить, что ДНК перемещается в цитоплазму другим путем (Sun et al., 2009). Кинетика однократного попадания при естественной трансформации плазмиды E. coli предполагает, что установление плазмиды в цитоплазме опосредуется не отжигом частично перекрывающейся противоположной оцДНК, полученной из двух независимых мономеров плазмиды, а новым путем, т.е. .е., перенос дцДНК через IM бактерий (Sun et al., 2009). Скрининг генов, связанных с трансформацией, нацеленной на RpoS, выявил ydcS и ydcV , которые расположены в одном опероне ABC-транспортера (Sun, 2016). Инактивация ярда и ярда снижает естественную трансформацию в 6,7 и 9,5 раз соответственно (Sun, 2016). Химическая трансформация также снижается при инактивации ydcS , тогда как химическая трансформация в мутанте ydcV не снижается по сравнению с его аналогом дикого типа (Sun, 2016).Согласно базе данных классификации транспортеров (TCDB), ydcS и ydcV , как предполагается, кодируют белки для связывания субстрата в периплазме и для транслокации субстрата через IM (Saier et al., 2014). YdcS был показан как PHB-синтаза в периплазме (Dai and Reusch, 2008). Мутант, у которого отсутствует ydcT (предполагаемый ген, кодирующий АТФазу) в том же опероне, что и ydcS и ydcV , естественно трансформируется с немного, но явно пониженной частотой (менее 50%) (Sun, 2016), что указывает на то, что это ген также участвует в естественной трансформации плазмиды E.coli . Тем не менее, что касается значительно сниженной частоты трансформации у мутантов ydcV и ydcS , ydcT , по-видимому, оказывает лишь незначительное влияние на транспорт ДНК. Вероятно, что для эффективного транспорта дцДНК через IM требуется дополнительный источник энергии.
Перенос неконъюгативных плазмид от клетки к клетке
Для конъюгации бактерий часто требуется межклеточный контакт. Следует отметить, что трансформация плазмиды E.coli в колониях протекает на поверхности чашек с агаром, и межклеточный контакт необходим для переноса плазмид, не несущих конъюгативных функций (Maeda et al., 2004, 2006). Зависимая от контакта клетка трансформация плазмид происходит не только в пределах одного и того же рода, но также и у разных родов (Wang et al., 2007). У некоторых естественно трансформируемых бактерий G — (например, H. influenzae и N. gonorrhoeae ) короткая последовательность ДНК (названная DUS) может увеличивать поглощение ДНК (Claverys and Martin, 2003; Wang and Sun, 2015; Zheng et al., 2017). Во время межклеточной контактно-зависимой трансформации плазмиды E. coli последовательность ДНК из 88 п.н. способствует переносу ДНК (Sobue et al., 2011). Скрининг коллекции Keio (Baba et al., 2006), обширной библиотеки из нокаут-мутантов E. coli , дефектных по несущественным генам, выявил rodZ , продукт которого регулирует палочковидную форму клетки. , как важный ген для межклеточной контакт-зависимой трансформации (Kurono et al., 2012). Поскольку гомологи генов захвата ДНК (например,g., ycaI ), не было обнаружено, что они являются важными генами, обычный механизм захвата ДНК, вероятно, не участвует в межклеточной контактно-зависимой трансформации плазмиды E. coli . Недавно у B. subtilis обнаружена межклеточная контактно-зависимая трансформация (Zhang et al., 2018). Однако инактивация регулятора компетенции ComK, который контролирует экспрессию консервативных генов захвата ДНК, отменяет передачу ДНК от клетки к клетке (Zhang et al., 2018), что свидетельствует о том, что механизмы передачи ДНК от клетки к клетке у E. coli и B. subtilis принципиально различаются.
Заключительные замечания
Классические механизмы HGT (т.е. естественная трансформация и конъюгация) имеют общие черты в том, что оцДНК выталкивается или втягивается в клетку с помощью ассоциированных с мембранами белковых комплексов. Недавние исследования выявили новые типы переноса ДНК, которые не зависят от классических механизмов захвата или конъюгации ДНК, что позволяет предположить, что в борьбе с ARG следует учитывать другие терапевтические цели.Консервативные белки, участвующие в транспортировке или защите ДНК, могут служить мишенями для ограничения переноса ARG и, в свою очередь, для снижения MDR у бактерий (Goessweiner-Mohr et al., 2013). С другой стороны, открытие неклассических механизмов HGT предполагает, что контролировать распространение ARG сложнее, чем считалось ранее.
Авторские взносы
DS придумал идею и написал рукопись.
Финансирование
Это исследование было поддержано Национальным фондом естественных наук Китая (гранты №31670084, 31100071) и Китайского фонда естественных наук провинции Чжэцзян (гранты № LY16C010003, Y3110237).
Заявление о конфликте интересов
Автор заявляет, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Сноски
Список литературы
Аас, Ф. Э., Вольфганг, М., Фрай, С., Данэм, С., Ловолд, К., и Куми, М. (2002). Компетенция в отношении естественной трансформации Neisseria gonorrhoeae : компоненты связывания и захвата ДНК, связанные с экспрессией ворсинок IV типа. Мол. Microbiol. 46, 749–760. DOI: 10.1046 / j.1365-2958.2002.03193.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Assalkhou, R., Balasingham, S., Collins, R.F., Frye, S.A., Davidsen, T., Benam, A.V, et al. (2007). Секретин внешней мембраны PilQ из Neisseria meningitidis связывает ДНК. Микробиология 153, 1593–1603. DOI: 10.1099 / mic.0.2006 / 004200-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Баба Т., Ара Т., Хасегава М., Такай Ю., Окумура Ю., Баба М. и др. (2006). Конструирование Escherichia coli K-12 в рамке считывания, нокаут-мутантов по одному гену: коллекция Кейо. Мол. Syst. Биол. 2: msb4100050. DOI: 10.1038 / msb4100050
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бейкер, Дж.А., Симкович, Ф., Тейлор, Х. М., Ригден, Д. Дж. (2016). Возможное связывание ДНК и нуклеазные функции доменов ComEC охарактеризованы in silico. Белки 84, 1431–1442. DOI: 10.1002 / prot.25088
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Баруки Р. и Смит Х. О. (1985). Повторное исследование фенотипических дефектов у мутантов rec-1 и rec-2 Haemophilus influenzae Rd. J. Bacteriol. 163, 629–634.
PubMed Аннотация | Google Scholar
Берге, М., Москосо, М., Прюдом, М., Мартин, Б., и Клаверис, Дж. П. (2002). Поглощение трансформирующей ДНК у грамположительных бактерий: взгляд из Streptococcus pneumoniae . Мол. Microbiol. 45, 411–421. DOI: 10.1046 / j.1365-2958.2002.03013.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Берка, Р. М., Хан, Дж., Альбано, М., Драшкович, И., Персу, М., Цуй, X., et al. (2002). Анализ микроматрицы K-состояния Bacillus subtilis : изменения экспрессии по всему геному в зависимости от ComK. Мол. Microbiol. 43, 1331–1345. DOI: 10.1046 / j.1365-2958.2002.02833.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Би, Д., Сюй, З., Харрисон, Э. М., Тай, К., Вэй, Ю., Хе, X. и др. (2012). ICEberg: Интернет-ресурс для интегративных и конъюгативных элементов, обнаруженных в бактериях. Nucleic Acids Res. 40, D621 – D626. DOI: 10.1093 / nar / gkr846
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Буркхардт, Дж., Вонк, Дж., И Аверхофф, Б. (2011). Структура и функция PilQ, секретина переносчика ДНК термофильной бактерии Thermus thermophilus HB27. J. Biol. Chem. 286, 9977–9984. DOI: 10.1074 / jbc.M110.212688
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кабесон, Э., Риполь-Розада, Дж., Пена, А., Де Ла Крус, Ф., Аречага, И. (2015). К интегрированной модели бактериальной конъюгации. FEMS Microbiol. Ред. 39, 81–95.DOI: 10.1111 / 1574-6976.12085
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чилтон, С. С., Фалбель, Т. Г., Хромада, С., и Бертон, Б. М. (2017). Консервативный металлсвязывающий мотив в Bacillus subtilis белка рвоты ComFA усиливает трансформацию. J. Bacteriol. 199: e00272-17. DOI: 10.1128 / JB.00272-17
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Клаверис, Дж. П., и Мартин, Б. (2003). Гены «компетентности» бактерий: признаки активной трансформации или только остатки? Тенденции.Microbiol. 11, 161–165. DOI: 10.1016 / S0966-842X (03) 00064-7
CrossRef Полный текст | Google Scholar
Клаверис, Дж. П., Мартин, Б., и Полард, П. (2009). Аппарат генетической трансформации: состав, локализация и механизм. FEMS Microbiol. Ред. 33, 643–656. DOI: 10.1111 / j.1574-6976.2009.00164.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Клаверис, Дж. П., Прюдом, М., и Мартин, Б. (2006). Индукция регулонов компетентности как общий ответ на стресс у грамположительных бактерий. Annu. Rev. Microbiol. 60, 451–475. DOI: 10.1146 / annurev.micro.60.080805.142139
CrossRef Полный текст | Google Scholar
Коллинз, Р. Ф., Давидсен, Л., Деррик, Дж. П., Форд, Р. К., и Тонджум, Т. (2001). Анализ секретина PilQ из Neisseria meningitidis с помощью просвечивающей электронной микроскопии показывает додекамерную четвертичную структуру. J. Bacteriol. 183, 3825–3832. DOI: 10.1128 / JB.183.13.3825-3832.2001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кьюри, Дж., Тушон, М., и Роча, Э. П. С. (2017). Интегративные и сопряженные элементы и их хозяева: состав, распределение и организация. Nucleic Acids Res. 45, 8943–8956. DOI: 10.1093 / nar / gkx607
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дай Д. и Ройш Р. Н. (2008). Поли-3-гидроксибутиратсинтаза из периплазмы Escherichia coli . Biochem. Биофиз. Res. Commun. 374, 485–489. DOI: 10.1016 / j.bbrc.2008.07.043
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Диалло, А., Фостер, Х. Р., Громек, К. А., Перри, Т. Н., Дужанкур, А., Крастева, П. В. и др. (2017). Бактериальная трансформация: ComFA — это ДНК-зависимая АТФаза, которая образует комплексы с ComFC и DprA. Мол. Microbiol. 105, 741–754. DOI: 10.1111 / mmi.13732
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Драшкович И., Дубнау Д. (2005). Биогенез предполагаемого канального белка ComEC, необходимого для захвата ДНК: топология мембраны, олигомеризация и образование дисульфидных связей. Мол. Microbiol. 55, 881–896. DOI: 10.1111 / j.1365-2958.2004.04430.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Даффин П. М., Барбер Д. А. (2016). DprA необходим для естественной трансформации и влияет на вариацию пилина в Neisseria gonorrhoeae . Микробиология 162, 1620–1628. DOI: 10.1099 / mic.0.000343
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Двиведи Г. Р., Шарма Э. и Рао Д.Н. (2013). Helicobacter pylori DprA снижает барьер рестрикции для входящей ДНК. Nucleic. Кислоты. Res. 41, 3274–3288. DOI: 10.1093 / nar / gkt024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эчууя, Р., Ито, М., Китано, С., Шиги, Ф., Собуэ, Р., и Маэда, С. (2011). Межклеточная трансформация в Escherichia coli : новый тип естественной трансформации с участием клеточной ДНК и предполагаемого промотирующего феромона. PLoS One 6: e16355. DOI: 10.1371 / journal.pone.0016355
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Форсберг, К. Дж., Рейес, А., Ван, Б., Селлек, Э. М., Соммер, М. О., и Дантас, Г. (2012). Общая устойчивость к антибиотикам почвенных бактерий и патогенов человека. Наука 337, 1107–1111. DOI: 10.1126 / science.1220761
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Franke, A. E., and Clewell, D. B. (1981).Доказательства конъюгального переноса транспозона Streptococcus faecalis (Tn916) из хромосомного участка в отсутствие плазмидной ДНК. Колд Спринг Харб. Symp. Quant. Биол. 45 (Pt 1), 77–80. DOI: 10.1101 / SQB.1981.045.01.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Goessweiner-Mohr, N., Arends, K., Keller, W., and Grohmann, E. (2013). Конъюгативные системы секреции типа IV у грамположительных бактерий. Плазмида 70, 289–302.DOI: 10.1016 / j.plasmid.2013.09.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Го, М., Ван, Х., Се, Н., и Се, З. (2015). Положительное влияние источников углерода на естественную трансформацию в Escherichia coli : роль низкоуровневого белка рецептора циклического АМФ (цАМФ) -цАМФ в дерепрессии rpoS. J. Bacteriol. 197, 3317–3328. DOI: 10.1128 / JB.00291-15
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хонг, Х., Сабо, Г., Тамм, Л. К. (2006). Электростатические связи в вентиляции ионных каналов OmpA предполагают механизм открытия пор. Nat. Chem. Биол. 2, 627–635. DOI: 10.1038 / nchembio827
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hovland, E., Beyene, G. T., Frye, S. A., Homberset, H., Balasingham, S. V., Gomez-Munoz, M., et al. (2017). DprA из Neisseria meningitidis : свойства и роль в естественной компетентности для трансформации. Микробиология 163, 1016–1029.DOI: 10.1099 / mic.0.000489
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Илангован А., Коннери С., Ваксман Г. (2015). Структурная биология систем конъюгации грамотрицательных бактерий. Тенденции. Microbiol. 23, 301–310. DOI: 10.1016 / j.tim.2015.02.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Илангован, А., Кей, К. В. М., Ройер, С., Эль Мками, Х., Сальвадори, Э., Зехнер, Э. Л. и др. (2017). Крио-ЭМ структура релаксазы раскрывает молекулярную основу раскручивания ДНК во время бактериальной конъюгации. Ячейка 169, 708.e12–721.e12. DOI: 10.1016 / j.cell.2017.04.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Инамин, Г. С., Дубнау, Д. (1995). ComEA, интегральный мембранный белок Bacillus subtilis , необходимый для генетической трансформации, необходим как для связывания ДНК, так и для транспорта. J. Bacteriol. 177, 3045–3051. DOI: 10.1128 / jb.177.11.3045-3051.1995
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джонсон, К.М., Гроссман А. Д. (2015). Интегративные и сопряженные элементы (ICE): что они делают и как работают. Annu. Преподобный Жене. 49, 577–601. DOI: 10.1146 / annurev-genet-112414-055018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джонстон, К., Мартин, Б., Фичант, Г., Полард, П., и Клаверис, Дж. П. (2014). Бактериальная трансформация: распространение, общие механизмы и дивергентный контроль. Nat. Rev. Microbiol. 12, 181–196. DOI: 10.1038 / nrmicro3199
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Куроно, Н., Matsuda, A., Etchuya, R., Sobue, R., Sasaki, Y., Ito, M., et al. (2012). Полногеномный скрининг генов Escherichia coli , участвующих в выполнении и стимулировании межклеточного переноса неконъюгативных плазмид: rodZ (yfgA) важна для восприятия плазмиды в реципиентных клетках. Biochem. Биофиз. Res. Commun. 421, 119–123. DOI: 10.1016 / j.bbrc.2012.03.127
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Laurenceau, R., Pehau-Arnaudet, G., Baconnais, S., Gault, J., Malosse, C., Dujeancourt, A., et al. (2013). Пилус типа IV опосредует связывание ДНК во время естественной трансформации в Streptococcus pneumoniae . PLoS Pathog. 9: e1003473. DOI: 10.1371 / journal.ppat.1003473
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ле С., Серрано Э., Кавамура Р., Карраско Б., Ян Дж. И Алонсо Дж. К. (2017). Bacillus subtilis RecA с DprA-SsbA противодействует функции RecX во время естественной трансформации. Nucleic. Кислоты. Res. 45, 8873–8885. DOI: 10.1093 / nar / gkx583
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Леонг, К. Г., Блумфилд, Р. А., Бойд, К. А., Дорнбуш, А. Дж., Либер, Л., Лю, Ф. и др. (2017). Роль основных и дополнительных генов ворсинок IV типа в естественной трансформации и судорожной подвижности у бактерии Acinetobacter baylyi . PLoS One 12: e0182139. DOI: 10.1371 / journal.pone.0182139
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю, Ю.Y., Wang, Y., Walsh, T.R., Yi, L.X., Zhang, R., Spencer, J., et al. (2016). Появление плазмид-опосредованного механизма устойчивости к колистину MCR-1 у животных и людей в Китае: микробиологическое и молекулярно-биологическое исследование. Ланцетная инфекция. Дис. 16, 161–168. DOI: 10.1016 / S1473-3099 (15) 00424-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лондоно-Вальехо, Дж. А. и Дубнау, Д. (1994). Мутация предполагаемого сайта связывания нуклеотидов мембранного белка Bacillus subtilis ComFA отменяет захват ДНК во время трансформации. J. Bacteriol. 176, 4642–4645. DOI: 10.1128 / jb.176.15.4642-4645.1994
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маэда, С., Ито, М., Андо, Т., Ишимото, Ю., Фудзисава, Ю., Такахаши, Х., и др. (2006). Горизонтальный перенос неконъюгативных плазмид в биопленку колонии Escherichia coli . FEMS Microbiol. Lett. 255, 115–120. DOI: 10.1111 / j.1574-6968.2005.00072.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маэда, С., Савамура, А., Мацуда, А. (2004). Трансформация колониальной Escherichia coli на твердой среде. FEMS Microbiol. Lett. 236, 61–64. DOI: 10.1111 / j.1574-6968.2004.tb09627.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мацуда А., Куроно Н., Кавано К., Широта К., Хирабаяси А., Хорино М. и др. (2012). Полногеномный скрининг генов Escherichia coli , участвующих в репрессии межклеточного переноса неконъюгативных плазмид. Biochem. Биофиз. Res. Commun. 428, 445–450. DOI: 10.1016 / j.bbrc.2012.10.098
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мацумото А., Секогути А., Имаи Дж., Кондо К., Шибата Ю. и Маэда С. (2016). Природные штаммы Escherichia coli подвергаются межклеточной плазмидной трансформации. Biochem. Биофиз. Res. Commun. 481, 59–62. DOI: 10.1016 / j.bbrc.2016.11.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мортье-Баррьер, И., Velten, M., Dupaigne, P., Mirouze, N., Pietrement, O., Mcgovern, S., et al. (2007). Ключевая пресинаптическая роль в трансформации широко распространенного бактериального белка: DprA передает входящую оцДНК к RecA. Ячейка 130, 824–836. DOI: 10.1016 / j.cell.2007.07.038
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Огура М., Ямагути Х., Кобаяси К., Огасавара Н., Фудзита Ю. и Танака Т. (2002). Полногеномный анализ генов, регулируемых транскрипционным фактором ComK Bacillus subtilis . J. Bacteriol. 184, 2344–2351. DOI: 10.1128 / JB.184.9.2344-2351.2002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пальчевский В., Финкель С. Е. (2006). Escherichia coli. Гомологи компетентных генов необходимы для конкурентоспособности и использования ДНК в качестве питательного вещества. J. Bacteriol. 188, 3902–3910. DOI: 10.1128 / JB.01974-05
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Зальцер, Р., Джус, Ф., и Аверхофф, Б. (2014). Биогенез пилуса типа IV, подергивание подвижности и захват ДНК в Thermus thermophilus : дискретные роли антагонистических АТФаз PilF, PilT1 и PilT2. заявл. Environ. Microbiol. 80, 644–652. DOI: 10.1128 / AEM.03218-13
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Зальцер Р., Керн Т., Джоос Ф. и Аверхофф Б. (2016). Оперон comEA / comEC Thermus thermophilus связан со связыванием ДНК и регуляцией транслокатора ДНК и пилей IV типа. Environ. Microbiol. 18, 65–74. DOI: 10.1111 / 1462-2920.12820
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Зейтц, П., Пезешги Модаррес, Х., Борго, С., Булушев, Р. Д., Стейнбок, Л. Дж., Раденович, А. и др. (2014). ComEA необходим для переноса внешней ДНК в периплазму в естественно трансформируемых клетках Vibrio cholerae . PLoS Genet. 10: e1004066. DOI: 10.1371 / journal.pgen.1004066
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шен, З., Ван, Ю., Шен, Ю., Шен, Дж., И Ву, К. (2016). Раннее появление mcr-1 в Escherichia coli у сельскохозяйственных животных. Ланцетная инфекция. Дис. 16: 293. DOI: 10.1016 / S1473-3099 (16) 00061-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Синха С., Мелл Дж. К. и Редфилд Р. Дж. (2012). Семнадцать Sxy-зависимых генов, сайт-регулируемых белка циклического АМФ-рецептора, необходимы для естественной трансформации в Haemophilus influenzae . J. Bacteriol. 194, 5245–5254. DOI: 10.1128 / JB.00671-12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Смитс, Л. К., и Кустерс, Дж. Г. (2002). Естественная трансформация в Helicobacter pylori: неожиданный транспорт ДНК. Тенденции. Microbiol 10, 159–162; обсуждение 162. doi: 10.1016 / S0966-842X (02) 02314-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Собуэ, Р., Куроно, Н., Эчуя, Р., и Маэда, С. (2011). Идентификация нового элемента ДНК, который способствует межклеточной трансформации в Escherichia coli . FEBS Lett. 585, 2223–2228. DOI: 10.1016 / j.febslet.2011.05.040
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вс, Д. (2011). Etude de la Transformation Plasmidique Naturelle D’escherichia Coli et De Ses Relations Eventuelles la compétence Programmée Pour la Transformation Génétique et la Compétence Dite Nutritionnelle .Кандидат наук. thesis, avec, Тулуза.
Google Scholar
Вс, Д. (2016). Два разных пути переноса двухцепочечной ДНК при естественной и искусственной трансформации Escherichia coli . Biochem. Биофиз. Res. Commun. 471, 213–218. DOI: 10.1016 / j.bbrc.2016.01.137
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сунь Д., Ван Б., Чжу Л., Чен М. и Чжан Л. (2013). Блокировать и усиливать перенос ДНК: противоположные роли OmpA в естественной и искусственной трансформации Escherichia coli . PLoS One 8: e59019. DOI: 10.1371 / journal.pone.0059019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Sun, D., Zhang, X., Wang, L., Prudhomme, M., Xie, Z., Martin, B., et al. (2009). Ортологи трансформирующего гена захвата ДНК не опосредуют спонтанную трансформацию плазмиды в Escherichia coli . J. Bacteriol. 191, 713–719. DOI: 10.1128 / JB.01130-08
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вс, Д., Zhang, Y., Mei, Y., Jiang, H., Xie, Z., Liu, H., et al. (2006). Escherichia coli естественным образом трансформируется в новой системе трансформации. FEMS Microbiol. Lett. 265, 249–255. DOI: 10.1111 / j.1574-6968.2006.00503.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Такено, М., Тагучи, Х., Акамацу, Т. (2011). Роль ComFA в контроле скорости поглощения ДНК во время трансформации компетентной Bacillus subtilis . Дж.Biosci. Bioeng. 111, 618–623. DOI: 10.1016 / j.jbiosc.2011.02.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Такено, М., Тагучи, Х., Акамацу, Т. (2012). Роль ComEA в захвате ДНК при трансформации компетентного Bacillus subtilis . J. Biosci. Bioeng. 113, 689–693. DOI: 10.1016 / j.jbiosc.2012.02.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цен, С. Д., Фанг, С. С., Чен, М.Дж., Чиен, Дж. Й., Ли, К. С. и Цен, Д. Х. (2002). Трансформация естественной плазмиды Escherichia coli . J. Biomed. Sci. 9, 246–252. DOI: 10.1159 / 000059425
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вининг, Дж. У., и Блокеш, М. (2017). Межбактериальное хищничество как стратегия приобретения ДНК у естественно компетентных бактерий. Nat. Rev. Microbiol. 15, 621–629. DOI: 10.1038 / nrmicro.2017.66
PubMed Аннотация | CrossRef Полный текст | Google Scholar
фон Винтерсдорф, К.Дж., Пендерс, Дж., Ван Никерк, Дж. М., Миллс, Н. Д., Маджумдер, С., Ван Альфен, Л. Б. и др. (2016). Распространение устойчивости к противомикробным препаратам в микробных экосистемах посредством горизонтального переноса генов. Фронт. Microbiol. 7: 173. DOI: 10.3389 / fmicb.2016.00173
CrossRef Полный текст | Google Scholar
Ван Б. и Сунь Д. (2015). Обнаружение Acinetobacter calcoaceticus и Acinetobacter junii , продуцирующих карбапенемазу NDM-1, в пробах окружающей среды с животноводческих ферм. J. Antimicrob. Chemother. 70, 611–613. DOI: 10.1093 / jac / dku405
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван, X., Ли, М., Ян, К., Чен, X., Гэн, Дж., Се, З. и др. (2007). Трансформация плазмид всего рода между Bacillus subtilis и Escherichia coli и влияние Escherichia coli на трансформирующую способность свободной плазмидной ДНК. Curr. Microbiol. 54, 450–456. DOI: 10.1007 / s00284-006-0617-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Возняк, Р.А., и Уолдор, М. К. (2010). Интегративные и конъюгативные элементы: мозаичные мобильные генетические элементы, обеспечивающие динамический латеральный поток генов. Nat. Rev. Microbiol. 8, 552–563. DOI: 10.1038 / nrmicro2382
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ядав Т., Карраско Б., Хейна Дж., Судзуки Ю., Такеясу К. и Алонсо Дж. К. (2013). Bacillus subtilis DprA рекрутирует RecA на одноцепочечную ДНК и опосредует отжиг комплементарных цепей, покрытых SsbB и SsbA. J. Biol. Chem. 288, 22437–22450. DOI: 10.1074 / jbc.M113.478347
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ядав Т., Карраско Б., Серрано Э. и Алонсо Дж. К. (2014). Роль Bacillus subtilis DprA и SsbA в RecA-опосредованной генетической рекомбинации. J. Biol. Chem. 289, 27640–27652. DOI: 10.1074 / jbc.M114.577924
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Йонг, Д., Толеман, М.А., Гиске, К. Г., Чо, Х. С., Сундман, К., Ли, К. и др. (2009). Характеристика нового гена металло-бета-лактамазы, bla (NDM-1) и нового гена эритромицинэстеразы, несущих уникальную генетическую структуру в последовательности Klebsiella pneumoniae типа 14 из Индии. Антимикробный. Агенты Chemother. 53, 5046–5054. DOI: 10.1128 / AAC.00774-09
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhang, X., Jin, T., Deng, L., Wang, C., Zhang, Y., и Chen, X.(2018). Стресс-индуцированная, высокоэффективная, зависимая от донорских клеток естественная трансформация от клетки к клетке в Bacillus subtilis . J. Bacteriol. 200: e00267-18. DOI: 10.1128 / JB.00267-18
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжан, Ю., Ши, К., Ю, Дж., Рен, Дж., И Сун, Д. (2012). RpoS регулирует новый тип переноса плазмидной ДНК в Escherichia coli . PLoS One 7: e33514. DOI: 10.1371 / journal.pone.0033514
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжэн, Б., Хуанг, К., Сюй, Х., Го, Л., Чжан, Дж., Ван, X., и др. (2017). Возникновение и геномная характеристика продуцирующего БЛРС, содержащего MCR-1 Escherichia coli в сельскохозяйственных почвах. Фронт. Microbiol. 8: 2510. DOI: 10.3389 / fmicb.2017.02510
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Что такое редактирование генома и CRISPR-Cas9 ?: MedlinePlus Genetics
Редактирование генома (также называемое редактированием генов) — это группа технологий, которые дают ученым возможность изменять ДНК организма.Эти технологии позволяют добавлять, удалять или изменять генетический материал в определенных местах генома. Было разработано несколько подходов к редактированию генома. Последняя известна как CRISPR-Cas9, что является сокращением от кластеризованных регулярно чередующихся коротких палиндромных повторов и CRISPR-ассоциированного белка 9. Система CRISPR-Cas9 вызвала большой интерес в научном сообществе, потому что она быстрее, дешевле, дороже. точный и более эффективный, чем другие существующие методы редактирования генома.
CRISPR-Cas9 был адаптирован из естественной системы редактирования генома бактерий. Бактерии захватывают фрагменты ДНК вторгшихся вирусов и используют их для создания сегментов ДНК, известных как массивы CRISPR. Массивы CRISPR позволяют бактериям «запоминать» вирусы (или близкие к ним). Если вирусы атакуют снова, бактерии производят сегменты РНК из массивов CRISPR, чтобы атаковать ДНК вирусов. Затем бактерии используют Cas9 или аналогичный фермент, чтобы разрезать ДНК, что выводит из строя вирус.
Система CRISPR-Cas9 работает аналогично в лаборатории. Исследователи создают небольшой фрагмент РНК с короткой «направляющей» последовательностью, которая прикрепляется (связывается) с определенной целевой последовательностью ДНК в геноме. РНК также связывается с ферментом Cas9. Как и в случае с бактериями, модифицированная РНК используется для распознавания последовательности ДНК, а фермент Cas9 разрезает ДНК в заданном месте. Хотя Cas9 является наиболее часто используемым ферментом, можно также использовать другие ферменты (например, Cpf1). После того, как ДНК разрезана, исследователи используют собственный механизм восстановления ДНК клетки для добавления или удаления частей генетического материала или для внесения изменений в ДНК, заменяя существующий сегмент индивидуализированной последовательностью ДНК.
Редактирование генома представляет большой интерес для профилактики и лечения заболеваний человека. В настоящее время большая часть исследований по редактированию генома проводится для понимания болезней с использованием клеток и животных моделей. Ученые все еще работают над тем, чтобы определить, является ли этот подход безопасным и эффективным для использования на людях. Он изучается в исследованиях по широкому кругу заболеваний, включая одногенные расстройства, такие как муковисцидоз, гемофилия и серповидно-клеточная анемия. Он также является многообещающим для лечения и профилактики более сложных заболеваний, таких как рак, болезни сердца, психические заболевания и инфекция, вызванная вирусом иммунодефицита человека (ВИЧ).
Этические проблемы возникают, когда редактирование генома с использованием таких технологий, как CRISPR-Cas9, используется для изменения генома человека. Большинство изменений, вносимых при редактировании генома, ограничиваются соматическими клетками, то есть клетками, отличными от яйцеклеток и сперматозоидов. Эти изменения затрагивают только определенные ткани и не передаются от поколения к поколению. Однако изменения, внесенные в гены в яйцеклетках или сперматозоидах (клетках зародышевой линии) или в генах эмбриона, могут быть переданы будущим поколениям. Редактирование зародышевых клеток и генома эмбриона поднимает ряд этических проблем, в том числе допустимо ли использовать эту технологию для улучшения нормальных человеческих качеств (таких как рост или интеллект).Из соображений этики и безопасности редактирование зародышевых клеток и генома эмбриона в настоящее время является незаконным во многих странах.
статей в научных журналах для дальнейшего чтения
Ormond KE (1), Mortlock DP (2), Scholes DT (3), Bombard Y (4), Brody LC (5), Faucett WA (6), Garrison NA (7), Hercher L (8), Isasi) Р. (9), Миддлтон А. (10), Мусунуру К. (11), Шрайнер Д. (12), Вирани А. (13), Янг К. Э. (3). Редактирование генома зародышевой линии человека. Am J Hum Genet. 2017 3 августа; 101 (2): 167-176. PubMed: 28777929. Полный текст доступен бесплатно в центре PubMed: PMC5544380.
Гупта Р.М., Мусунуру К. Расширение набора инструментов генетического редактирования: ZFN, TALEN и CRISPR-Cas9. J Clin Invest. 2014 Октябрь; 124 (10): 4154-61.

 6 ГЭ/мл.
6 ГЭ/мл.
 2008 Aug;74(15):4898-909.
2008 Aug;74(15):4898-909. При наличии субъективных и объективных симптомов, со стороны урогенитального тракта
При наличии субъективных и объективных симптомов, со стороны урогенитального тракта , ПЦР Метод:
Полимеразная цепная реакция
, ПЦР Метод:
Полимеразная цепная реакция  при температуре от 2 до 8 градусов Цельсия
при температуре от 2 до 8 градусов Цельсия Прекратить прием интравагинальных средств различного назначения (суппозитории, спермициды, спринцевания, тампоны, местные процедуры и др.). Важно: Сдавать до лечения или через 21 день после окончания антибактериальной, антимикотической терапии (если иное не определено врачом).
Прекратить прием интравагинальных средств различного назначения (суппозитории, спермициды, спринцевания, тампоны, местные процедуры и др.). Важно: Сдавать до лечения или через 21 день после окончания антибактериальной, антимикотической терапии (если иное не определено врачом).
 9 КОЕ/мл, что составляет от 90 до 99,9% всей микрофлоры влагалища.
9 КОЕ/мл, что составляет от 90 до 99,9% всей микрофлоры влагалища. 
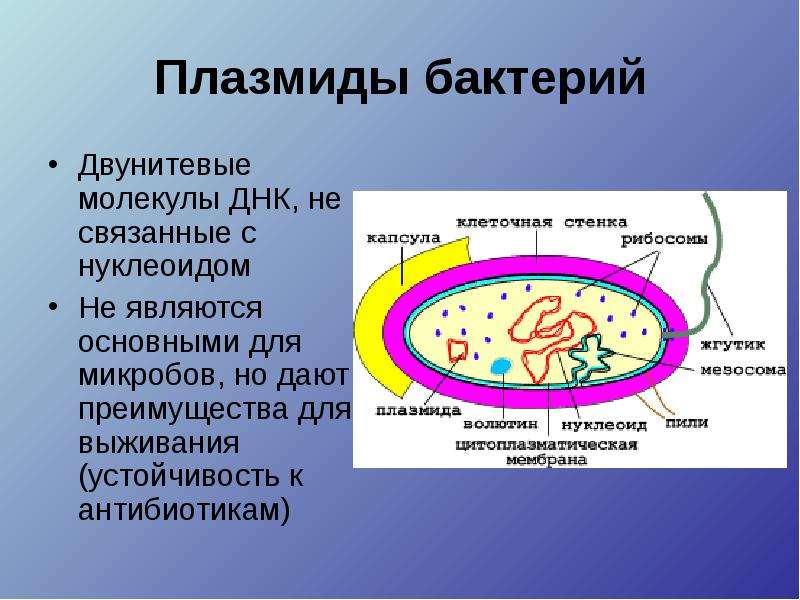

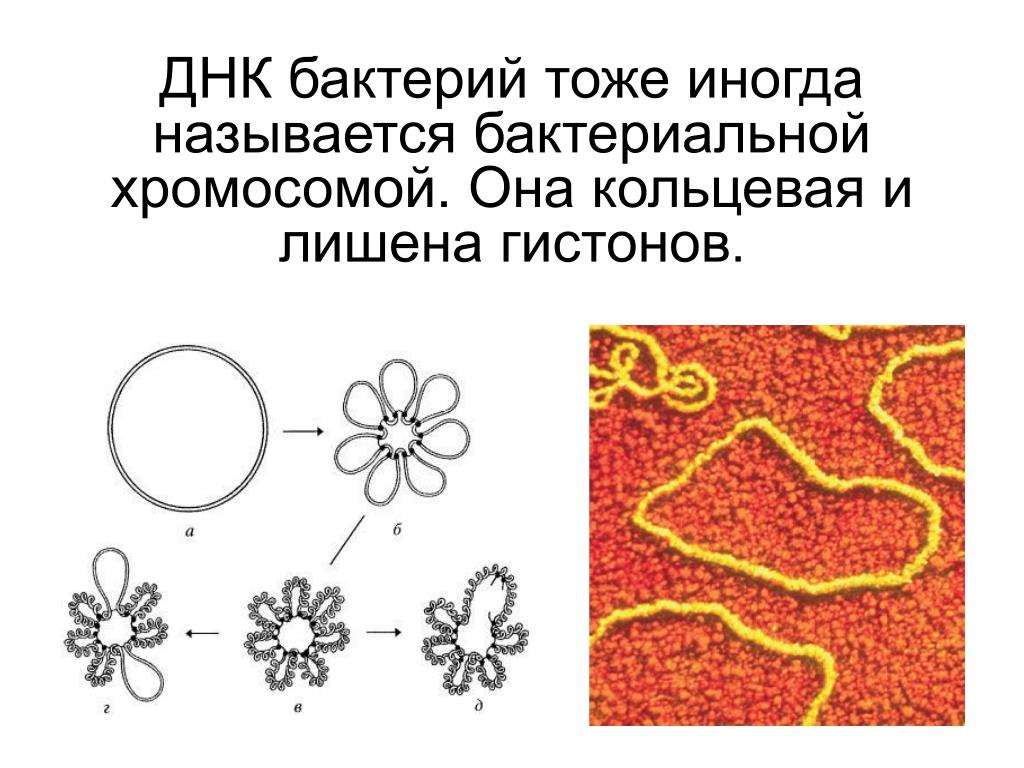




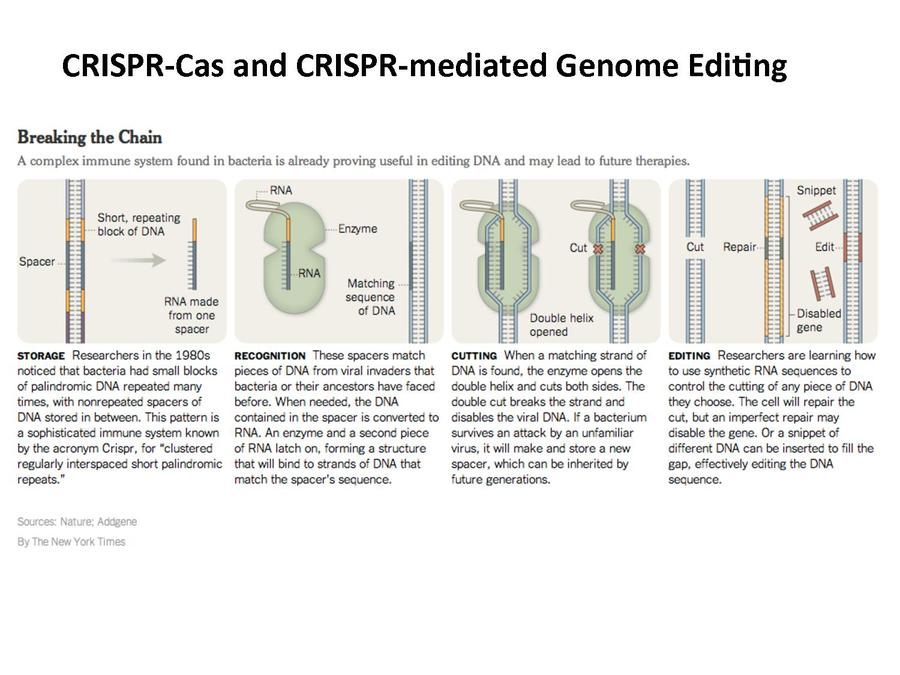


 01.2016
01.2016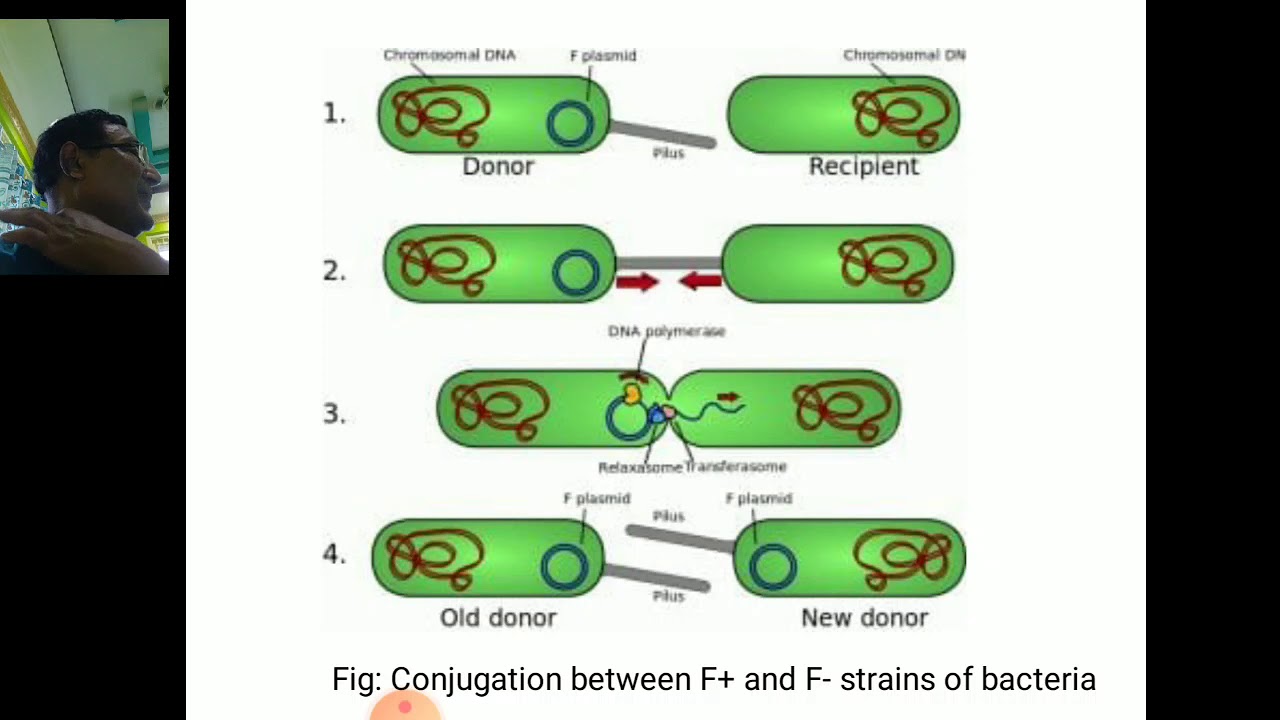 10.2016
10.2016
 А.»,
А.», А.»,
А.», ; наконечники одноразовые — 50 шт.; держатели для наконечников — 50 шт.; пробирки для образцов — 50 шт.; пробирки для элюента — 50 шт.; инструкция — 1 шт.; карта со штрих — кодом — 1 шт.; пробирка с буфером G2 — 1 шт.; пробирки с протеиназой К — 2 шт.; пробирка с переносчиком РНК — 1 шт.
; наконечники одноразовые — 50 шт.; держатели для наконечников — 50 шт.; пробирки для образцов — 50 шт.; пробирки для элюента — 50 шт.; инструкция — 1 шт.; карта со штрих — кодом — 1 шт.; пробирка с буфером G2 — 1 шт.; пробирки с протеиназой К — 2 шт.; пробирка с переносчиком РНК — 1 шт./dna-structure-562597795-5ae77532c06471003681d684.jpg)
 ; штативы с ферментами — 2 шт.; прокалывающие крышки — 2 шт.; буферы AVE — 2 пробирки; буферы AVE — 2 флакона; пленки многоразовые — 2 упаковки; переносчики РНК — 2 пробирки
; штативы с ферментами — 2 шт.; прокалывающие крышки — 2 шт.; буферы AVE — 2 пробирки; буферы AVE — 2 флакона; пленки многоразовые — 2 упаковки; переносчики РНК — 2 пробирки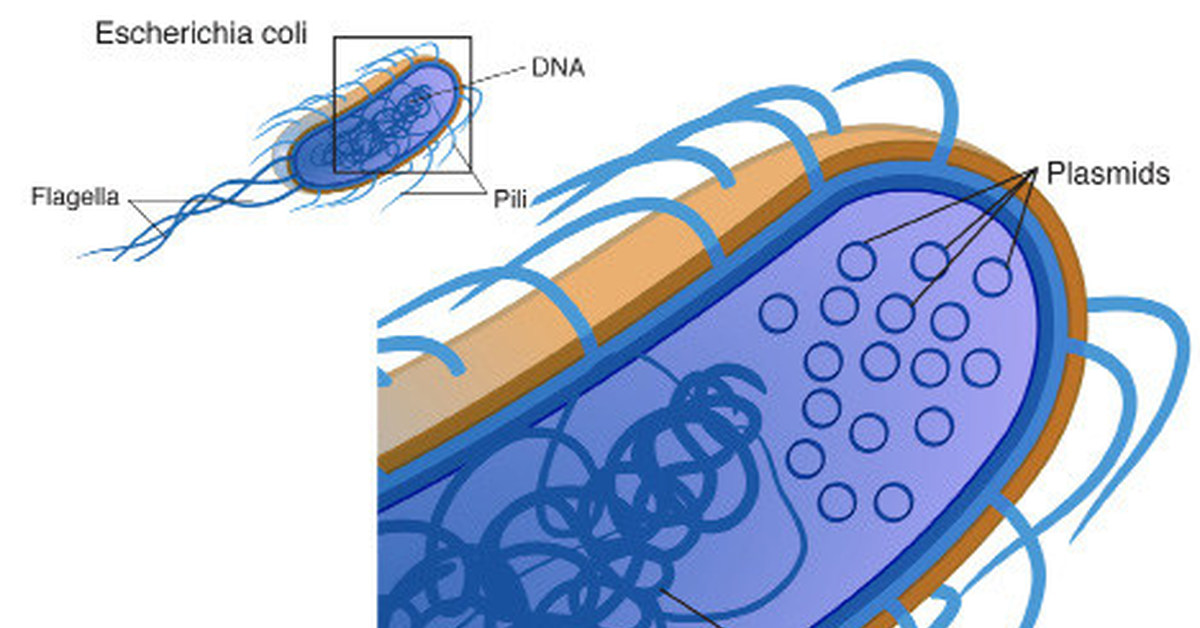 ; штативы с ферментами — 2 шт.; прокалывающие крышки — 2 шт.; буфер ATE — 1 флакон; пленки многоразовые — 2 упаковки
; штативы с ферментами — 2 шт.; прокалывающие крышки — 2 шт.; буфер ATE — 1 флакон; пленки многоразовые — 2 упаковки







 Б.)
Б.) ))
)) ))
))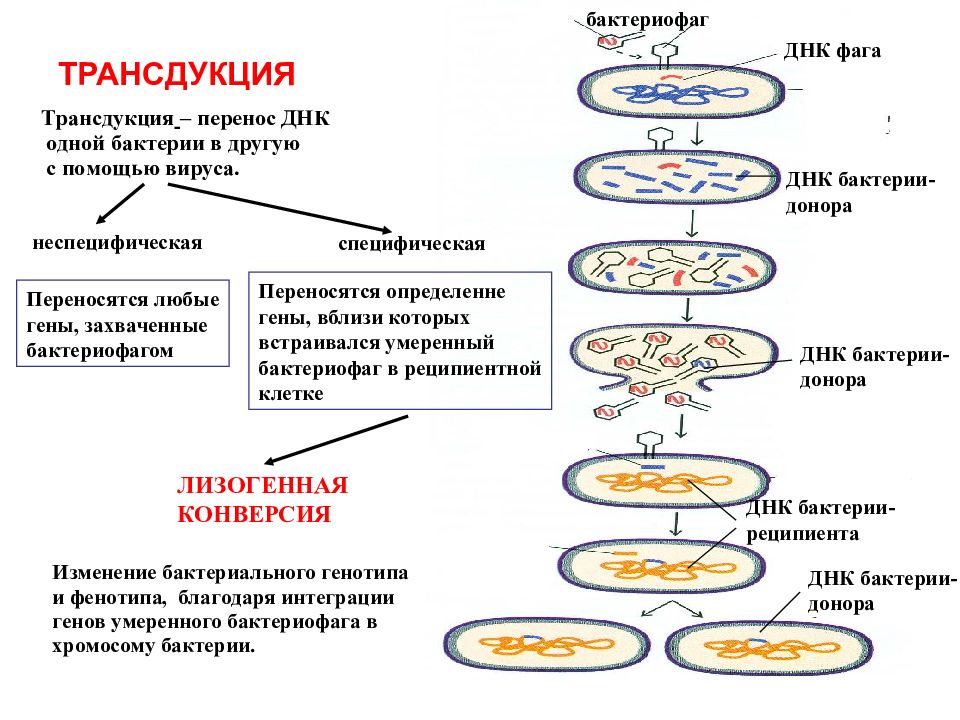 В послед-
В послед-
 Все данные
Все данные 18 образцов (см. раздел «Результаты и обсужде-
18 образцов (см. раздел «Результаты и обсужде- п.) и, расположенной на 3’ – конце последо-
п.) и, расположенной на 3’ – конце последо- Температурный профиль реакции: 98 °С –
Температурный профиль реакции: 98 °С – Наука 264 , 572–575 (1994).
Наука 264 , 572–575 (1994).
 Дж., Дьюар, С.J. & Donachie, W. D. Новый ген деления клеток Escherichia coli , ftsK . J. Bacteriol. 177 , 6211–6222 (1995). Открытие функции клеточного деления белка FtsK.
Дж., Дьюар, С.J. & Donachie, W. D. Новый ген деления клеток Escherichia coli , ftsK . J. Bacteriol. 177 , 6211–6222 (1995). Открытие функции клеточного деления белка FtsK.  , Х.-C., Tran, A.H., Sun, Q. & Margolin, W. Локализация белка клеточного деления FtsK в перегородке Escherichia coli и идентификация потенциального N-концевого целевого домена. J. Bacteriol. 180 , 1296–1304 (1998).
, Х.-C., Tran, A.H., Sun, Q. & Margolin, W. Локализация белка клеточного деления FtsK в перегородке Escherichia coli и идентификация потенциального N-концевого целевого домена. J. Bacteriol. 180 , 1296–1304 (1998). и другие. Жизненно важный краситель для изучения динамики мембран у бактерий: новый механизм, контролирующий септацию во время споруляции Bacillus subtilis . Мол. Microbiol. 31 , 1149–1159 (1999).
и другие. Жизненно важный краситель для изучения динамики мембран у бактерий: новый механизм, контролирующий септацию во время споруляции Bacillus subtilis . Мол. Microbiol. 31 , 1149–1159 (1999). Мол. Microbiol. 31 , 579–583 (1999). Неожиданное открытие роли FtsK в разрешении димеров хромосом.
Мол. Microbiol. 31 , 579–583 (1999). Неожиданное открытие роли FtsK в разрешении димеров хромосом. 
 А. и Пиггот, П. Дж. Рассказ о двух геномах: разрешение димерных хромосом в Escherichia coli и Bacillus subtilis . Res.Microbiol. 151 , 503–511 (2000).
А. и Пиггот, П. Дж. Рассказ о двух геномах: разрешение димерных хромосом в Escherichia coli и Bacillus subtilis . Res.Microbiol. 151 , 503–511 (2000). Мол. Microbiol. 19 , 1127–1135 (1996).
Мол. Microbiol. 19 , 1127–1135 (1996).